金属冶炼:金属冶炼是把金属从化合态变为游离态的过程
矿石 ①工业上能用来提炼金属的矿物叫做矿石。
②常见的矿石赤铁矿(Fe
2O
3)、黄铁矿(FeS
2)、褐铁矿(Fe
2O
3·xH
2O)、水铝石(Al
2O
3·H
2O)、菱铁矿(主要成分是FeCO
3)、磁铁矿(Fe
3O
4)、方铅矿(PbS)、孔雀石 [Cu
2(OH)
2CO
3]、赤铜矿(Cu
2O)、铝土矿(主要成分是Al
2O
3)、黄铜矿(主要成分是CuFeS
2)、辉铜矿(主要成分是Cu2S)。
铁的冶炼
①
原理:把铁矿石冶炼成铁是一个复杂的过程,其主要的反应原理是:
在高温下,利用还原剂一氧化碳把铁从铁矿石里还原出来,其反应的化学方程式是: Fe
2O
3+3CO

2Fe+3CO
2 ②
炼铁的原料及作用:
铁矿石:提供原料
焦炭:提供能量,产生还原剂
石灰石:将矿石中的二氧化硅转变为炉渣。
③
设备:高炉
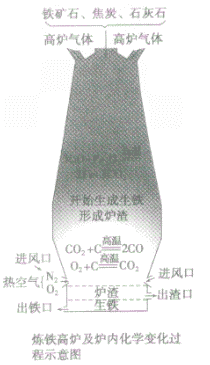
④
高炉内有关反应:
a.产生CO提供能量:C+O
2
CO
2;CO
2+C

2CO
b.在高温下用CO将Fe从Fe
2O
3中还原出来:3CO+ Fe
2O
3
2Fe + 3CO
2 c.用石灰石将矿石中的SiO
2转变为炉渣除去。
CaCO
3
CaO+CO
2↑,CaO+SiO
2
CaSiO
3⑤
产品:生铁
炼铁高炉中出铁口低于出渣口的原因:炼铁高炉中出铁口与出渣口的高低取决于铁水和炉渣的密度〔铁水的密度大于炉渣的密度)。
金属的冶炼方法: ①
热分解法(适用于Hg,Ag不活泼的金属的冶炼,加热使其氧化物分解) 如:
2HgO=Hg+O
2↑
②
热还原法(适用于金属活动性顺序表中,Zn- Cu金属的冶炼)
a.用H
2作还原剂(优点:制得金属纯度高,污染小) 如:Fe
3O
4+4H
2
3Fe+4H
2O
b.用焦炭、一氧化碳作还原剂(易混入杂质,污染大气,适合工业化大规模生产) 如:
炼铁的反应方程式为Fe
2O
3+3CO

2Fe +3CO
2炼锌的反应万程式为2ZnO+C

2Zn+CO
2↑
c.用Al作还原剂(铝热剂用来焊接铁轨) 如:
8Al+3Fe
3O
4
9Fe+4Al
2O
3 d.电解法(适用于活泼金属Na,Mg等的冶炼) 如:
2NaCl(熔融)

2Na+Cl
2↑ ;MgCl
2(熔融)

Mg+Cl
2↑
e.湿法冶金(从溶液中通过化学反应来获取金属) 如:
Fe+CuSO
4==Cu+FeSO
4
金属锈蚀: 金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
| 实验装置 |
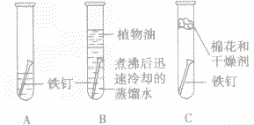 |
| 实验现象 |
几天后观察A试管中铁钉生锈,在水面附近锈蚀
严重,B,C试管中的铁钉没有生锈 |
| 实验分析 |
A试管中的铁钉同时跟水、空气(或氧气)接触而生锈;
B试管中的铁钉只与水接触不生锈;
C 试管中的铁钉只与干燥的空气(或氧气)接触不生锈 |
| 实验结论 |
铁生锈的条件是与水、空气(或氧气)同时接触 |
易错点:①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe
2O
3·H
2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu
2(OH)
2CO
3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法: (1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe
2O
3+6HCl==2FeCl
3+3H
2O或Fe
2O
3+3H
2SO
4==Fe
2(SO
4)
3+3H
2O。
定义:
金属回收是指从废旧金属中分离出来的有用物质经过物理或机械加工成为再生利用的制品。是从回收、拆解、到再生利用的一条产业链。
保护金属资源的途径:
(1)回收利用废旧金属;
(2)防止金属制品锈蚀;
(3)合理地、有计划地开采金属矿物;
(4)寻找替代品。
废旧金属的回收利用的优点:
(1)废旧金属的回收利用可以节约金属资源和能源。
(2)废旧金属的回收还可以保护环境,减少对环境的污染。