本试题 “某同学用下图形式对所学知识进行归纳,其中甲包含了乙、丙、丁…下列归纳的对应关系中,正确的组是[ ]A、甲:溶于水,溶液升温;乙丙丁:浓硫酸、生石灰、硝酸...” 主要考查您对分解反应
化合反应
置换反应
溶解过程中的放热和吸热
酸、碱、盐
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 分解反应
- 化合反应
- 置换反应
- 溶解过程中的放热和吸热
- 酸、碱、盐
概念:
由一种物质生成两种或两种以上物质的反应
特征:
一变多
表达式:
A = B + C
初中常见的分解反应:
按产物种类多少分类:
一、加热分解的产物有两种
1.分解成两种单质
⑴气态氢化物的分解
碘化氢的分解2HI=H2↑+I2
⑵氯化银的分解
氯化银的分解2AgCl=2Ag+Cl2↑
⑶电解
电解水2H2O 2H2↑+O2↑
2H2↑+O2↑
2.分解成两种化合物
⑴不稳定盐类的分解
碳酸钙的高温分解CaCO3 CaO+CO2↑
CaO+CO2↑
⑵不稳定弱碱的分解
氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
⑶不稳定弱酸的分解
碳酸的分解H2CO3=H2O+CO2↑
⑷含结晶水的盐类的脱水
十水碳酸钠的风化Na2CO3·10H2O=Na2CO3+10H2O
3.分解成一种单质和一种化合物
⑴不太稳定的盐类的分解
氯酸钾的催化分解2KClO3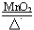 2KCl+3O2↑
2KCl+3O2↑
⑵不稳定酸的分解
次氯酸的分解2HClO=2HCl+O2
⑶双氧水的分解
受热(或以二氧化锰为催化剂)分解2H2O2=2H2O+O2
4.有机物的分解
甲烷的裂解2CH4=C2H2+3H2
二、加热分解的产物有三种
1.不稳定盐类的分解
⑴碳酸氢钠受热分解2NaHCO3=Na2CO3+CO2↑+H2O
⑵亚硫酸的酸式强碱盐受热分解
亚硫酸氢钠受热分解 2NaHSO3=Na2SO4+SO2↑+H2O
⑶铵盐的受热分解
碳酸铵受热分解
(NH4)2CO3=2NH3↑+H2O↑+CO2↑
⑷高锰酸钾受热分解
2KMnO4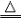 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
⑸硝酸盐的受热分解
硝酸银的受热分解2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
4HNO3=4NO2+O2+2H2O
3.电解水溶液
⑴电解饱和食盐水
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
按反应物种类进行分类:
1.酸的分解反应。
⑴含氧酸=非金属氧化物+水 如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
⑵某些含氧酸的分解比较特殊, 如
硝酸的分解: 4HNO3(浓)=4NO2↑+O2↑+2H2O,
次氯酸分解 2HClO=2HCl+O2↑
磷酸脱水 4H3PO4 (HPO3)4+4H2O↑ ;
(HPO3)4+4H2O↑ ;
2H3PO4 H4P2O7+H2O↑
H4P2O7+H2O↑
3H3PO4 H5P3O10+2H2O↑
H5P3O10+2H2O↑
2.碱的分解反应:
活泼金属的氢氧化物较难分解,难溶性碱一般都较易分解: 2Al(OH)3=Al2O3+3H2O, 2Fe(OH)3=Fe2O3+3H2O, Cu(OH)2=CuO十H2O。
3.盐的分解反应:
碳酸盐、硝酸盐、铵盐一般都较易分解,且反应表现出一定的规律性。
⑴碳酸盐的分解:
碳酸盐=金属氧化物十CO2↑ 如CaCO3 CaO+CO2↑,CuCO3
CaO+CO2↑,CuCO3 CuO+CO2↑
CuO+CO2↑
K2CO3、Na2CO3比较稳定,很难分解,而其酸式盐较易分解:
2NaHCO3=Na2CO3+CO2↑+H2O
Ca(HCO3)2=CaCO3+CO2↑+H2O
⑵硝酸盐的分解反应。硝酸盐受热均易分解,并放出氧气,其规律大体如下:
活动性强的金属(K、Ca、Na)硝酸盐=亚硝酸盐+O2↑:
如 2KNO3=2KNO2+O2↑。
处于活动性顺序表中间的金属(Mg、Cu等)的硝酸盐=金属氧化物+NO2↑+O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑ 2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活动金属(Hg、Ag、Au)的硝酸盐=金属+NO2↑+O2↑:
如 Hg(NO3)2=Hg+2NO2↑+O2↑; 2AgNO3=2Ag+2NO2↑+O2↑
⑶铵盐的分解反应。铵盐受热易分解,一般都有氨气放出:
如(NH4)2SO4=2NH3↑+H2SO4 ;NH4HCO3=NH3↑+CO2↑+H2O。
⑷其它盐类的分解反应
如 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反应:
非金属氧化物一般不容易发生分解反应 2H2O2=H2↑+O2↑
金属氧化物一般分解的规律是: 金属活动顺序表中,排在铜后的金属氧化物受热易分解:
如 2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活泼的金属氧化物,给它们熔化态通电流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑
由一种物质生成两种或两种以上物质的反应
特征:
一变多
表达式:
A = B + C
初中常见的分解反应:
按产物种类多少分类:
一、加热分解的产物有两种
1.分解成两种单质
⑴气态氢化物的分解
碘化氢的分解2HI=H2↑+I2
⑵氯化银的分解
氯化银的分解2AgCl=2Ag+Cl2↑
⑶电解
电解水2H2O
 2H2↑+O2↑
2H2↑+O2↑2.分解成两种化合物
⑴不稳定盐类的分解
碳酸钙的高温分解CaCO3
 CaO+CO2↑
CaO+CO2↑ ⑵不稳定弱碱的分解
氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
⑶不稳定弱酸的分解
碳酸的分解H2CO3=H2O+CO2↑
⑷含结晶水的盐类的脱水
十水碳酸钠的风化Na2CO3·10H2O=Na2CO3+10H2O
3.分解成一种单质和一种化合物
⑴不太稳定的盐类的分解
氯酸钾的催化分解2KClO3
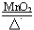 2KCl+3O2↑
2KCl+3O2↑⑵不稳定酸的分解
次氯酸的分解2HClO=2HCl+O2
⑶双氧水的分解
受热(或以二氧化锰为催化剂)分解2H2O2=2H2O+O2
4.有机物的分解
甲烷的裂解2CH4=C2H2+3H2
二、加热分解的产物有三种
1.不稳定盐类的分解
⑴碳酸氢钠受热分解2NaHCO3=Na2CO3+CO2↑+H2O
⑵亚硫酸的酸式强碱盐受热分解
亚硫酸氢钠受热分解 2NaHSO3=Na2SO4+SO2↑+H2O
⑶铵盐的受热分解
碳酸铵受热分解
(NH4)2CO3=2NH3↑+H2O↑+CO2↑
⑷高锰酸钾受热分解
2KMnO4
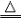 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ ⑸硝酸盐的受热分解
硝酸银的受热分解2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
4HNO3=4NO2+O2+2H2O
3.电解水溶液
⑴电解饱和食盐水
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
按反应物种类进行分类:
1.酸的分解反应。
⑴含氧酸=非金属氧化物+水 如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
⑵某些含氧酸的分解比较特殊, 如
硝酸的分解: 4HNO3(浓)=4NO2↑+O2↑+2H2O,
次氯酸分解 2HClO=2HCl+O2↑
磷酸脱水 4H3PO4
 (HPO3)4+4H2O↑ ;
(HPO3)4+4H2O↑ ;2H3PO4
 H4P2O7+H2O↑
H4P2O7+H2O↑ 3H3PO4
 H5P3O10+2H2O↑
H5P3O10+2H2O↑ 2.碱的分解反应:
活泼金属的氢氧化物较难分解,难溶性碱一般都较易分解: 2Al(OH)3=Al2O3+3H2O, 2Fe(OH)3=Fe2O3+3H2O, Cu(OH)2=CuO十H2O。
3.盐的分解反应:
碳酸盐、硝酸盐、铵盐一般都较易分解,且反应表现出一定的规律性。
⑴碳酸盐的分解:
碳酸盐=金属氧化物十CO2↑ 如CaCO3
 CaO+CO2↑,CuCO3
CaO+CO2↑,CuCO3 CuO+CO2↑
CuO+CO2↑K2CO3、Na2CO3比较稳定,很难分解,而其酸式盐较易分解:
2NaHCO3=Na2CO3+CO2↑+H2O
Ca(HCO3)2=CaCO3+CO2↑+H2O
⑵硝酸盐的分解反应。硝酸盐受热均易分解,并放出氧气,其规律大体如下:
活动性强的金属(K、Ca、Na)硝酸盐=亚硝酸盐+O2↑:
如 2KNO3=2KNO2+O2↑。
处于活动性顺序表中间的金属(Mg、Cu等)的硝酸盐=金属氧化物+NO2↑+O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑ 2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活动金属(Hg、Ag、Au)的硝酸盐=金属+NO2↑+O2↑:
如 Hg(NO3)2=Hg+2NO2↑+O2↑; 2AgNO3=2Ag+2NO2↑+O2↑
⑶铵盐的分解反应。铵盐受热易分解,一般都有氨气放出:
如(NH4)2SO4=2NH3↑+H2SO4 ;NH4HCO3=NH3↑+CO2↑+H2O。
⑷其它盐类的分解反应
如 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反应:
非金属氧化物一般不容易发生分解反应 2H2O2=H2↑+O2↑
金属氧化物一般分解的规律是: 金属活动顺序表中,排在铜后的金属氧化物受热易分解:
如 2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活泼的金属氧化物,给它们熔化态通电流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑
概念:指的是由两种或两种以上的物质生成一种新物质的反应。其中部分反应为氧化还原反应,部分为非氧化还原反应。 此外,化合反应一般释放出能量。
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2 CO2
CO2
3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2 2NaCl
2NaCl
4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2 2H2O
2H2O
5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2 SO2
SO2
10.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2
 CO2
CO2 3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2
 2NaCl
2NaCl 4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2
 2H2O
2H2O 5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2
 SO2
SO210.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气
 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4概念:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
| 规律 | 发生条件 | 实例 |
| H2+金属氧化物→金属+水 | ①加热 ②K、Ca、Na、Mg、Al等的氧化物除外 |
H2+CuO Cu+H2O Cu+H2O3H2+Fe2O3 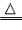 2Fe+3H2O 2Fe+3H2O |
| 碳+金属氧化物→金属+CO2 | ①高温 ②K、Ca、Na、Mg、Al等的氧化物除外 |
C+2CuO 2Cu+CO2↑ 2Cu+CO2↑3C+2Fe2O3  4Fe+3CO2↑ 4Fe+3CO2↑ |
| 金属+酸→盐+氢气 | ①浓硫酸,硝酸具有氧化性,和金属反应不生成氢气; ②在金属活动性顺序中排在氢前面的金属才能置换出酸中的氢 |
Zn+2HCl==ZnCl2+H2↑ Zn+H2SO4(稀)==ZnSO4+H2↑ 2Al+3H2SO4(稀)==Al2(SO4)3+3H2↑ |
| 金属+盐→新盐+新金属 | ①盐必须能溶于水 ②在金属活动性顺序表中,排在前面的金属才能置换出后面的金属 ③钾、钙、钠很活泼,与盐溶液反应不能置换出金属 |
Cu+Hg(NO3)2==Hg+Cu(NO3)2 Fe+CuSO4=FeSO4+Cu |
概念:
在溶解过程中发生了两种变化,一种是溶质的分子(或离子)在水分子的作用下向水中扩散,这一过程吸收热量;另一种是扩散的溶质的分子(或离子)和水分子作用,生成水和分子(或水和离子),这一过程放出热量。
物质溶解过程中的两种变化:
扩散过程:溶质的分子(或离子)向水中扩散,是物理过程,吸收热量
水合过程:溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),是化学过程,放出热量
溶解过程中的温度变化:
a.扩散过程中吸收的热量>水合过程中放出的热量,溶液温度降低,如:NH4NO3溶解于水。
b.扩散过程中吸收的热量<水合过程中放出的热摄,溶液温度升高,如:NaOH、浓硫酸溶解于水。
c.扩散过程中吸收的热量≈水合过程中放出的热量,溶液温度几乎不变,如:NaCl溶解于水。
常见冷冻混合物:
在生产、生活中常用冰作冷却剂,但冰只能提供 0℃左右的低温。一些医疗和研究单位常需要更低的温度,提供低温较方便的方法是用冷冻混合物。
下表是几种常见冷冻混合物的组成及所能达到的最低温度。
在溶解过程中发生了两种变化,一种是溶质的分子(或离子)在水分子的作用下向水中扩散,这一过程吸收热量;另一种是扩散的溶质的分子(或离子)和水分子作用,生成水和分子(或水和离子),这一过程放出热量。
物质溶解过程中的两种变化:
扩散过程:溶质的分子(或离子)向水中扩散,是物理过程,吸收热量
水合过程:溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),是化学过程,放出热量
溶解过程中的温度变化:
a.扩散过程中吸收的热量>水合过程中放出的热量,溶液温度降低,如:NH4NO3溶解于水。
b.扩散过程中吸收的热量<水合过程中放出的热摄,溶液温度升高,如:NaOH、浓硫酸溶解于水。
c.扩散过程中吸收的热量≈水合过程中放出的热量,溶液温度几乎不变,如:NaCl溶解于水。
常见冷冻混合物:
在生产、生活中常用冰作冷却剂,但冰只能提供 0℃左右的低温。一些医疗和研究单位常需要更低的温度,提供低温较方便的方法是用冷冻混合物。
下表是几种常见冷冻混合物的组成及所能达到的最低温度。
| 冷冰混合物的组成 | 最低温度 |
| 41gNH4NO3和100g冰 | -17 |
| 19NH4Cl和100g冰 | -16 |
| 23gNaCl和100g冰 | -21 |
| 22gMgCl2和100g冰 | -34 |
酸:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
| 从化学组成看 | 从电离观点看 | 组成特点 | |
| 酸 | 由氢元素和酸根组成 | 电离时生成的阳离子全都是氢离子(H+)的化合物 | 一定含氢元素 |
| 碱 | 由金属元素和氢氧根组成(氨水也是碱) | 电离时生成的阴离子全都是氢氧根离子(OH-)的化合物 | 一定含氢、氧 元素 |
| 盐 | 含有金属元素(或NH4+) 和酸根 | 电离时能生成金属离子(或NH4+)和酸根离子的化合物 | 酸式盐中一定含氢元素,碱式盐中一定含氢、氧元素 |
发现相似题
与“某同学用下图形式对所学知识进行归纳,其中甲包含了乙、丙、...”考查相似的试题有:
- 工业上常用如下反应制取金属镁:MgCl2(熔融)Mg+Cl2↑,该反应属于[ ]A.化合反应B.分解反应C.置换反应D.复分解反应
- 电解水生成氢气和氧气的反应为:2H2O2H2↑+O2↑,该反应属于[ ]A.化合反应B.置换反应C.复分解反应D.分解反应
- 如图所示的微观变化与下列反应及反应类型对应正确的是[ ]A.2CO + O22CO2化合反应B.2HI + Cl2===2HCl + I2置换反应C.2H2O2H...
- 2007年第二期的《化学世界》杂志上报道了浙江大学化学工程研究所以丁铵(二正丁基二硫代磷酸铵)和氯化锌为原材料合成二正丁...
- 海洋资源的开发前景十分广泛,下图是我们从海水中提取镁的流程图:上述一系列转化过程中,未涉及的基本反应类型是_________;...
- 下列洗涤方法中利用了乳化原理的是A.用汽油洗去手上的油污B.用洗洁精洗去餐具上的油污C.用酒精洗去试管中的碘D.用稀盐酸...
- 下列各组选项中,有错误的一组是( )A.合金-不锈钢、锡焊、生铁B.碱类-烧碱、纯碱、熟石灰C.干燥剂-浓硫酸、生石灰、...
- 在下表的空格中写出相应的物质名称、化学式及物质的类别(物质类别指单质、氧化物、酸、碱、盐).物质名称氯化铵______氮气...
- 化学兴趣小组的同学在实验室发现一瓶保管不当,盛有无色溶液的试剂瓶,且标签破损(如图),其残缺的标签中只剩下“Na"。老师...
- 下列叙述中,错误的是( )A.碳酸钠俗称纯碱,属于碱类B.石蕊溶液遇碱溶液变成蓝色C.酸溶液遇石蕊溶液变成红色D.酸溶液与...