本试题 “下列说法中,正确的是[ ]A.电解精炼钢时,粗铜中的金、银、锌等形成阳极泥而与铜分离B.易潮解的试剂都要用带磨口玻璃塞的广口瓶保存C.氨可将NO2转化成无毒...” 主要考查您对氨气
电解精炼铜
化学药品的保存、放置
酸碱中和滴定
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氨气
- 电解精炼铜
- 化学药品的保存、放置
- 酸碱中和滴定
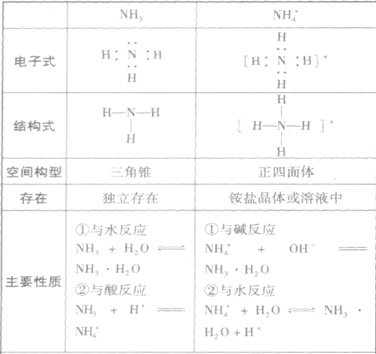
氨:
NH3的电子式为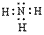 ,结构式为
,结构式为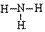 ,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
氨的物理性质和化学性质:
1.物理性质:
氨是无色、有刺激性气味的气体,比空气轻;氨易液化,在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热。液态氨气化时要吸收大量的热,使周围的温度急剧下降;氨气极易溶于水,在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);氨对人的眼、鼻、喉等粘膜有刺激作用,若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
2.化学性质:
(1)与水反应, ,氨的水溶液叫做氨水。在氨水中所含的微粒有:
,氨的水溶液叫做氨水。在氨水中所含的微粒有:
 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。
(2)与酸反应生成铵盐反应实质为:
反应原理拓展NH3分子中N原子有一对孤电子,能够跟有空轨道的H+形成配位键: 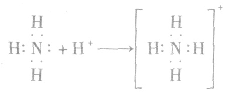
(3)具有还原性  (工业制HNO3的基础反应)
(工业制HNO3的基础反应) (Cl2过量)
(Cl2过量) (NH3过量,可用于检验Cl2瓶是否漏气)
(NH3过量,可用于检验Cl2瓶是否漏气)  (实验室制N2)
(实验室制N2)
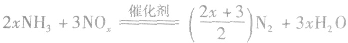 (治理氮氧化物污染)
(治理氮氧化物污染)
(4)与CO2反应制尿素 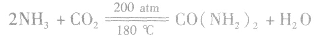
(5)配合反应
 的比较:
的比较:
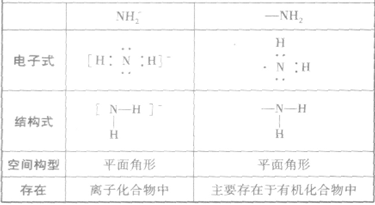
氨的结构与性质的关系总结:

氨的用途:
(1)氨是氮肥工业及制造硝酸、铵盐、纯碱等的重要原料。
(2)氨也是有机合成工业(如制尿素、合成纤维、染料等)上的常用原料。
(3)氨还可用作制冷剂。
对实验室制氨气常见问题的解释:
l.制取氨气时为什么用的铵盐一般是氯化铵而不是硝铵、硫铵或碳铵实验室制氨气用 固体混合反应,加热时反应速率显著增大。因为
固体混合反应,加热时反应速率显著增大。因为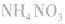 在加热时可能发生爆炸性的分解反应:
在加热时可能发生爆炸性的分解反应: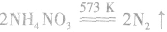
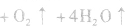 ,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成
,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成 ,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用
,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用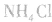 。
。
2.不用铵盐与强碱反应能否制取氨气能。
①加热浓度在20%以上的浓氨水,若浓度不够可加人适量固体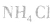 和生石灰(CaO)或烧碱:
和生石灰(CaO)或烧碱: 
②将浓氨水滴入盛有固体烧碱或生石灰(CaO)的烧瓶中,使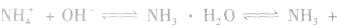
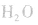 平衡右移,放出
平衡右移,放出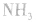 ,且NaOH、CaO溶于水均放热,可降低
,且NaOH、CaO溶于水均放热,可降低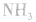 ,在水中的溶解度。
,在水中的溶解度。
③将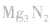 溶于水或使尿素在碱性条件下水解。
溶于水或使尿素在碱性条件下水解。 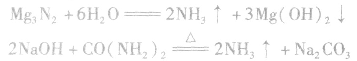
3.为什么制NH3用Ca(OH)2而不用NaOH ①固体NaOH易吸湿结块,不易与铵盐混合充分而反应;②在加热条件下,NaOH易腐蚀玻璃仪器。
4.制NH3的装置有哪些注意事项
①收集装置和发生装置的试管和导管必须是干燥的,因为氨气易溶于水;
②发生装置的试管口略向下倾斜,以免生成的水倒流使试管炸裂;
③导管应插入收集装置的底部,以排尽装置中的空气;
④收集NH3的试管口塞一团棉花,作用是防止NH3与空气形成对流,使收集的NH3较纯,还可防止NH3逸散到空气中。
5.用什么方法收集NH3只能用向下排空气法,因为NH3极易溶于水,密度又比空气小。
6.怎样收集干燥的NH3将NH3通过盛有碱石灰或固体NaOH的干燥管,但不能选用浓 、无水
、无水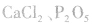 等作干燥剂,因为它们均能与NH3发生反应。
等作干燥剂,因为它们均能与NH3发生反应。
7.怎样检验NH3已充满试管把湿润的红色石蕊试纸放在试管口处,若试纸变蓝,则NH3已充满;把蘸有浓盐酸的玻璃棒接近试管口,若产生大量白烟,则NH3已充满。
精炼铜:
(1)要求
(2)反应原理如下图所示: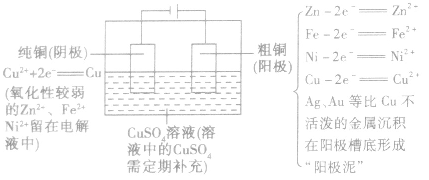
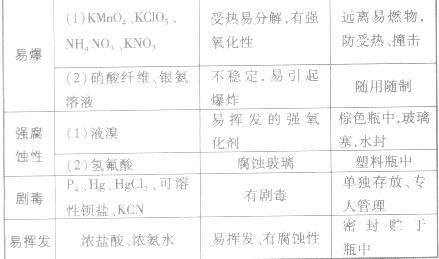
一、 防挥发:
1 .油封:氨水,浓盐酸,浓硝酸等易挥发无机液体,在液面上滴 10 ~ 20 滴矿物油,可以 防止挥发(不可用植物油)。
2 .水封:二硫化碳中加 5mL 水,便可长期保存。汞上加水,可防汞蒸气进入空气。汞旁放 些硫粉,一但失落,散布硫粉使遗汞消灭于化学反应中。
3 .腊封:乙醚、乙醇、甲酸等比水轻的或易溶性挥发液体,以及萘、碘等易挥发固体,紧 密瓶塞,瓶口涂腊。 溴除进行原瓶腊封外,应将原瓶置于具有活性炭的塑料筒内, 筒口进行 腊封。
二、防潮:
1 .漂白粉、过氧化钠应该进行腊封,防止吸水分解或吸水爆炸。氢氧化钠易吸水潮解,应 该进行腊封; 硝酸铵、 硫酸钠易吸水结状, 倒不出来, 以至导致试剂瓶破裂, 也应严密腊封。
2 .碳化钙、无水硫酸铜、五氧化二磷、硅胶极易吸水变质,红磷易被氧化,然后吸水生成 偏磷酸,以上各物均应存放在干燥器中。
3 .浓硫酸虽应密闭,防止吸水,但因常用,故宜放磨口瓶中,磨口瓶塞应该原配,切勿对调。
4 .“ 特殊药品 ” 的地下室,下层布块灰,中层布熟石灰上层布双层柏油纸,方可存放药物。
三、防变质:
1 .防氧化:亚硫酸钠、硫酸亚铁、硫代硫酸钠均易被氧化,瓶口应涂腊。
2 .防碳酸化:硅酸钠、过氧化钠、苛性碱均易吸收二氧化碳,应该涂腊。
3 .防风化:晶体碳酸钠、晶体硫酸铜应进行腊封,存放在地下室中。
4 .防分解:碳酸氢铵、浓硝酸受热易分解,涂腊后,存放在地下室中。
5 .活性炭能吸附多种气体而变质,(木炭亦同),应放在干燥器中。
6 .黄磷遇空气易自燃,永远保存水中,每 15 天查水一次:磷试剂瓶中加水、置于有水水 糟中,上加钟罩封闭。
7 .钾、钠保存在火油中。
8.硫酸亚铁溶液中滴几滴稀硫酸,加入过量细铁粉,进行腊封。
9 .葡萄糖溶液容易霉变,稍加几滴甲醛即可保存。
10 .甲醛易聚合,应开瓶后立即加少量甲醇;乙醛则加乙醇。
四、防光:
1 .硝酸银,浓硝酸及大部份有机药品应该放在棕色瓶中。
2 .硝酸盐存放在地下室中既防热,又防光、防火还能防震。
3 .有机试剂橱窗一律用黑漆涂染。
4 .实验室用色布窗帘,内红外黑双层。
五、防毒害:
1 .磷、硝酸银、氯酸钾、氯化汞等剧毒物放地下室内,双人双锁,建立档案,呈批取用, 使用记载,定期检查。
2 .磷化钙、磷化铝吸水后放出剧毒性磷化氢,应放在干燥器中保存,贴上红色标签。
3 .由于没有通风橱,经常在地面布石灰,吸附某些毒害气相物质。
4 .浓酸,浓碱、溴、酚等腐蚀的药物,使用红色标签,以示警戒。
六、防震:
1 .硝酸铵震动易爆炸,放地下室中。
2 .自制的大晶体明矾、大晶体硫酸铜,用软纸垫包放大口试剂瓶中,进行缓冲,并按 “ 四位 数字 ” 进行编号入厨。
易变质和具有危险性药品的特性及保存方法:

酸碱中和滴定:
用已知物质的量浓度的酸(或碱)来测 定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
(1)原理:对于一元酸和一元碱发生的中和反应,C酸V酸=C碱V碱 或:C未知V未知=C标准V标准,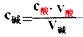
(2)仪器:a.酸式滴定管 b.碱式滴定管c.铁架台d.滴定管夹e.锥形瓶 f.烧杯g.胶头滴管等
(3)装置图: 
(4)操作步骤:
洗涤、检漏、水洗、润洗、装液、去泡、调液面记录、放待测液、加指示剂、滴定、记录、
计算、误差分析
(5)数据处理依据:
c(NaOH)=c(HCl)V(HCl)/V(NaOH)
(6)误差分析:
①仪器润洗不当:
a.盛标准液的滴定管用蒸馏水洗后未用标准液润洗;
b.盛待测液滴定(移液)管用蒸馏水洗后未用待测液润洗;
c.锥形瓶用蒸馏水洗后再用待测液润洗;
②读数方法有误:
a.滴定前仰视,滴定后俯视;
b.滴定前俯视,滴定后仰视;
c.天平或量筒的使用读数方法错误;
③操作出现问题:
a.盛标准液的滴定管漏液;
b.盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡
(或前无后有);
c.振荡锥形瓶时,不小心有待测液溅出;
d.滴定过程中,将标准液滴到锥形瓶外;
中和滴定中的误差分析:
中和滴定是一个要求较高的定量实验,每一个不当的或错误的操作都会引起误差。
对于一元酸与一元碱,由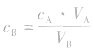 可知,
可知,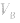 是准 确量取的体积,
是准 确量取的体积, 是标准溶液的浓度,它们均为定值,所以
是标准溶液的浓度,它们均为定值,所以 的大小取决于
的大小取决于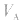 的大小,
的大小,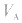 大则
大则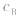 大,
大,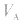 小则
小则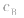 小。
小。
以标准酸溶液滴定末知浓度的碱溶液(酚酞作指示剂)为例,常见的不正确操作对实验结果的影响见下表: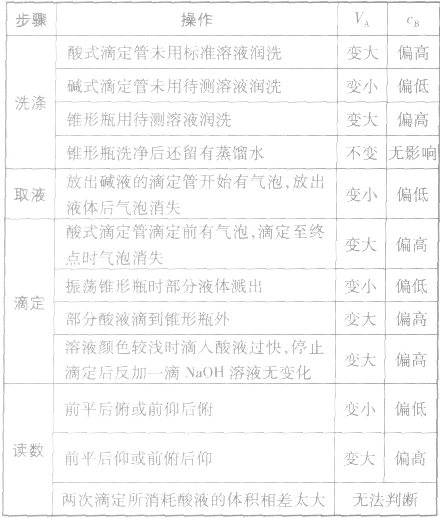
中和滴定应注意的问题:
1.中和滴定中指示剂的使用与选择
(1)用量不能太多,常用2~3滴,冈指示剂本身也是有机弱酸或有机弱碱,若用量太多,会使中和滴定中需要的酸或碱的量增多或减少。
(2)指示剂的选择:中和滴定时一般选用的指示剂有酚酞和甲基橙。石蕊试液由于颜色变化不明显,不易辨别,在滴定过程中不宜使用。
(3)酸、碱恰好完全反应时,终点溶液的pH应在指示剂的变色范围内,如强酸溶液滴定弱碱溶液应选用甲基橙作指示剂;强碱溶液滴定弱酸溶液应选用酚酞作指示剂。
(4)指示剂的变色:最好由浅到深,这样对比明显。如用强碱滴定强酸用酚酞作指示剂较好,当酚酞从无色变为粉红色(或浅红色)且半分钟内不褪色时即达到滴定终点。
2.欲减小实验误差的三点做法
(1)半分钟:振荡,半分钟内颜色不褪去,即为滴定终点。
(2)l一2min:滴定停止后,必须等待l~2min,让附着在滴定管内壁的溶液流下后,再进行读数。
(3)重复:同一实验,要做两到三次,两次滴定所用标准溶液的体积的差值不能超过0.02mL,再取平均值。
与“下列说法中,正确的是[ ]A.电解精炼钢时,粗铜中的金、银、...”考查相似的试题有:
- 下列各组物质按右图所示转化关系每一步都能一步实现的是[ ]甲 乙丙丁A.FeCl3 FeCl2Fe2O3Fe(OH)3B.Cu CuOCuSO4CuCl2C.NO HNO3N...
- 下列物质在一定条件下不能和水反应的是( )A.NH3B.CuC.乙烯D.淀粉
- 用人工方法在舞台上制造云雾缭绕的幻境的方法是( )A.燃烧白磷B.燃烧镁粉C.施放干冰D.浓盐酸浓氨水同时喷晒
- 下列叙述中正确的是[ ]①锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液能加快反应速率②镀层破损后,白铁(镀锌的铁)比马口铁...
- 下列有关工业生产的叙述正确的是[ ]A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率B.硫酸工业中...
- 从化学试剂商店购买的某些试剂瓶上常贴有危险化学品的标志.盛装浓硝酸的试剂瓶上所贴的危险化学品标志是( )A.B.C.D.
- 下列实验操作或所记录的数据合理的是( )A.NaOH溶液保存在玻璃塞的试剂瓶中B.液溴应盛放在用水密封且用玻璃塞塞紧的棕色试...
- 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室...
- 实验室中,欲配制一定物质的量浓度的稀硫酸,并用来测定未知浓度的烧碱溶液。①用24. 5% 硫酸(密度为1. 20 g/cm3)配制100 mL...
- 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,...