本试题 “下列实验装置图及实验操作对实验现象的描述正确的是( )A.配制溶液时向容量瓶中转移溶液B.实验室制备少量氢气C.有一条明亮的“光路”D.收集氨气” 主要考查您对胶体
气体的收集、净化、干燥
配制一定物质的量浓度的溶液
通过实验装置图判断实验的可行性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 胶体
- 气体的收集、净化、干燥
- 配制一定物质的量浓度的溶液
- 通过实验装置图判断实验的可行性
胶体:
胶体:分散质粒子直径在10-9m~10-7m之间的分散系胶粒直径的大小是胶体的本质特征
胶体可分为固溶胶、液溶胶、气溶胶
①常见的液溶胶:Fe(OH)3、AgI、牛奶、豆浆、粥等
②常见的气溶胶:雾、云、烟等;
③常见的固溶胶:有色玻璃、烟水晶等胶体的性质:
丁达尔效应:
①当光束通过氢氧化铁胶体时,可以看到一条光亮的通路,这条光亮的通路是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,即为丁达尔效应。
②布朗运动:粒子在不停地、无秩序的运动
③电泳:胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里定向移动。一般来讲:金属氢氧化物,金属氧化物的胶粒吸附阳离子,胶体微粒带正电荷;非金属氧化物,金属硫化物的胶体胶粒吸附阴离子,胶体微粒带负电荷。
④胶体聚沉:向胶体中加入少量电解质溶液时,由于加入的阳离子(或阴离子)中和了胶体粒子所带的电荷,使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出。该过程不可逆。
胶体:分散质粒子直径在10-9m~10-7m之间的分散系胶粒直径的大小是胶体的本质特征
胶体可分为固溶胶、液溶胶、气溶胶
①常见的液溶胶:Fe(OH)3、AgI、牛奶、豆浆、粥等
②常见的气溶胶:雾、云、烟等;
③常见的固溶胶:有色玻璃、烟水晶等胶体的性质:
丁达尔效应:
①当光束通过氢氧化铁胶体时,可以看到一条光亮的通路,这条光亮的通路是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,即为丁达尔效应。
②布朗运动:粒子在不停地、无秩序的运动
③电泳:胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里定向移动。一般来讲:金属氢氧化物,金属氧化物的胶粒吸附阳离子,胶体微粒带正电荷;非金属氧化物,金属硫化物的胶体胶粒吸附阴离子,胶体微粒带负电荷。
④胶体聚沉:向胶体中加入少量电解质溶液时,由于加入的阳离子(或阴离子)中和了胶体粒子所带的电荷,使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出。该过程不可逆。
胶体的特性:
(1)丁达尔效应当一束光通过胶体时,胶体内会出现一条光亮的通路,这是由胶体粒子对光线散射而形成的,利用丁达尔效应可区分胶体和浊液。
(2)介稳性:胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,但改变条件就有可能发生聚沉。
(3)聚沉:给胶体加热、加入电解质或加入带相反电荷的胶体颗粒等均能使胶体粒子聚集成较大颗粒,从而形成沉淀从分散剂里析出。聚沉常用来解释生活常识,如长江三角洲的形成、明矾净水等。
(4)电泳现象:在电场作用下,胶体粒子在分散剂中作定向移动。电泳现象说明胶体粒子带电。电泳常用来分离提纯胶体,如工业上静电除尘。
分散系比较:
| 分散系 | 溶液 | 胶体 | 悬浊液 | 乳浊液 |
| 分散质粒子大小 | <1nm | 1~100nm | >100nm | >100nm |
| 分散质粒子结构 | 分子、离子 | 少量分子的结合体或大分子 | 大量分子聚集成的固体小颗粒 | 大量分子聚集成的液体小液滴 |
| 特点 | 均一、透明、稳定 | 多数均一、透明、较稳定 | 不均一、不透明、久置沉淀 | 不均一、不透明、久置分层 |
| 能否透过滤纸 | 能 | 能 | 不能 | —— |
| 实例 | 食盐水、蔗糖溶液 | Fe(OH)3(胶体)、淀粉胶体 | 泥水、石灰乳 | 牛奶、油漆 |
胶体发生聚沉的条件:
因胶粒带电,故在一定条件下可以发生聚沉:
- 向胶体中滴加电解质
- 向胶体中加入带相反电荷胶粒的胶体
- 加热
常见的胶体的带电情况:
- 胶粒带正电荷的胶体有:金属氧化物、金属氢氧化物。例如Fe(OH)3、Al(OH)3等。
- 胶粒带负电荷的胶体有:非金属氧化物、金属硫化物、硅酸胶体、土壤胶体。
- 胶粒不带电的胶体有:淀粉胶体。
- 特殊的,AgI胶粒随着AgNO3和KI相对量不同,而带正电或负电。若KI过量,则AgI胶粒吸附较多I-而带负电;若AgNO3过量,则因吸附较多Ag+而带正电。
注意:胶体不带电,而胶粒可以带电。
Fe(OH)3胶体的制备:
操作步骤:将烧杯中的蒸馏水加热至沸腾,向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至呈红褐色为止。
离子方程式:Fe3++3H2O=(加热)=Fe(OH)3(胶体)+3H+
点拨:(1)淀粉溶液、蛋白质溶液虽叫做溶液,但属于胶体。
(2)胶体可以是液体,也可以是固体、气体,如烟、云、雾、有色玻璃等。
收集方法及装置:
a.排水集气法:适用于收集不溶于水,不与水反应的气体。装置如下:如采用第二个装置,气体应短进长出。

b.向上排空气法:适用于收集密度比空气大不与空气反应的气体,装置如下:如采用第二个装置,气体应长进短出。

c.向下排空气法:适用于收集密度比空气小不与空气反应的气体。装置如下:如采用第二个装置,气体应短进长出。
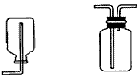
气体净化:
装置: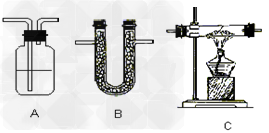

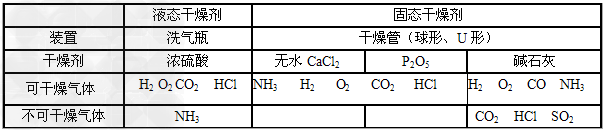
气体干燥:
(1)干燥原则:
干燥剂只能吸收气体中含有的水分而不能与气体发生反应。
①酸性干燥剂不能干燥碱性气体。
②碱性干燥剂不能干燥酸性气体。
③具有强氧化性的干燥剂不能干燥具有强还原性的气体。注意H2、CO、SO2虽具有还原性,但可用浓H2SO4干燥。
(2)常见物质干燥
a.排水集气法:适用于收集不溶于水,不与水反应的气体。装置如下:如采用第二个装置,气体应短进长出。

b.向上排空气法:适用于收集密度比空气大不与空气反应的气体,装置如下:如采用第二个装置,气体应长进短出。

c.向下排空气法:适用于收集密度比空气小不与空气反应的气体。装置如下:如采用第二个装置,气体应短进长出。

气体净化:
装置:


气体干燥:
(1)干燥原则:
干燥剂只能吸收气体中含有的水分而不能与气体发生反应。
①酸性干燥剂不能干燥碱性气体。
②碱性干燥剂不能干燥酸性气体。
③具有强氧化性的干燥剂不能干燥具有强还原性的气体。注意H2、CO、SO2虽具有还原性,但可用浓H2SO4干燥。
(2)常见物质干燥

配置一定物质的量浓度的溶液:
(1)仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管
(2)原理:c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)
(3)步骤:
第一步:计算。
第二步:称量:在天平上称量溶质,并将它倒入小烧杯中。
第三步:溶解:在盛有溶质的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2~3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1~2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
(4)误差分析:
①计算是否准确
若计算的溶质质量(或体积)偏大,则所配制的溶液浓度也偏大;反之浓度偏小。
如配制一定浓度的CuSO4溶液,把硫酸铜的质量误认为硫酸铜晶体的质量,导致计算值偏小,造成所配溶液浓度偏小。
②称、量是否无误
如称量NaOH固体在纸上或称量时间过长,会导致NaOH部分潮解甚至变质,有少量NaOH黏附在纸上,造成所配溶液浓度偏低。
量取液体溶质时,俯视或仰视量筒读数,会导致所取溶质的量偏少或偏多,造成所配溶液浓度偏小或偏大。
使用量筒量取液体溶质后再用蒸馏水冲洗量筒,把洗涤液也转入烧杯稀释,或用移液管将液体溶质移入烧杯中后把尖嘴处的残留液也吹入烧杯中。在制造量筒、移液管及滴定管时,已经把仪器内壁或尖嘴处的残留量扣除,所以上述操作均使溶质偏多,造成所配溶液浓度偏大。
③称量时天平未调零
结果不能确定。若此时天平重心偏左,则出称量值偏小,所配溶液的浓度也偏小;若重心偏小,则结果恰好相反。
④称量时托盘天平的砝码生锈
砝码由于生锈而使质量变大,导致称量值偏大,所配溶液的浓度偏高。
⑤操作中溶质有无损失
在溶液配制过程中,若溶质有损失,会使所配溶液浓度偏低。如:⑴溶解(或稀释)溶质,搅拌时有少量液体溅出;⑵未洗涤烧杯或玻璃棒;⑶洗涤液未转入容量瓶;⑷转移洗涤液时有少量液体溅出容量瓶。
影响溶液体积V的操作有:
①定容时不慎加水超过容量瓶的刻度线,再用胶头滴管吸出,使液面重新达到刻度线。当液面超过刻度线时,V偏大使溶液浓度CB已变小,无论是否取出都无法使溶液恢复,只有重新配制。
②定容后盖上瓶塞,摇匀后发现液面低于刻度线,再滴加蒸馏水使液面重新达到刻度线。定容时由于少量溶液粘在瓶颈处没有回流,使液面偏低但溶液浓度未变,若再加水,则使V偏大,cB偏小。
③定容时仰视或俯视
定容时仰视,则液面高于刻度线,V偏大,cB偏小;俯视时液面低于刻度线,V偏小,cB偏大。
④移液或定容时玻璃棒下端放在容量瓶刻度线之上
会导致V偏大,cB偏小。
⑤溶液未冷却至室温即转移入容量瓶
溶解或稀释过程常伴有热效应而使溶液温度升高或降低。容量瓶的使用温度为室温(20℃),若定容时溶液温度高于室温,会使所配溶液浓度偏高;反之浓度偏低。
(1)仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管
(2)原理:c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)
(3)步骤:
第一步:计算。
第二步:称量:在天平上称量溶质,并将它倒入小烧杯中。
第三步:溶解:在盛有溶质的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2~3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1~2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
(4)误差分析:
①计算是否准确
若计算的溶质质量(或体积)偏大,则所配制的溶液浓度也偏大;反之浓度偏小。
如配制一定浓度的CuSO4溶液,把硫酸铜的质量误认为硫酸铜晶体的质量,导致计算值偏小,造成所配溶液浓度偏小。
②称、量是否无误
如称量NaOH固体在纸上或称量时间过长,会导致NaOH部分潮解甚至变质,有少量NaOH黏附在纸上,造成所配溶液浓度偏低。
量取液体溶质时,俯视或仰视量筒读数,会导致所取溶质的量偏少或偏多,造成所配溶液浓度偏小或偏大。
使用量筒量取液体溶质后再用蒸馏水冲洗量筒,把洗涤液也转入烧杯稀释,或用移液管将液体溶质移入烧杯中后把尖嘴处的残留液也吹入烧杯中。在制造量筒、移液管及滴定管时,已经把仪器内壁或尖嘴处的残留量扣除,所以上述操作均使溶质偏多,造成所配溶液浓度偏大。
③称量时天平未调零
结果不能确定。若此时天平重心偏左,则出称量值偏小,所配溶液的浓度也偏小;若重心偏小,则结果恰好相反。
④称量时托盘天平的砝码生锈
砝码由于生锈而使质量变大,导致称量值偏大,所配溶液的浓度偏高。
⑤操作中溶质有无损失
在溶液配制过程中,若溶质有损失,会使所配溶液浓度偏低。如:⑴溶解(或稀释)溶质,搅拌时有少量液体溅出;⑵未洗涤烧杯或玻璃棒;⑶洗涤液未转入容量瓶;⑷转移洗涤液时有少量液体溅出容量瓶。
影响溶液体积V的操作有:
①定容时不慎加水超过容量瓶的刻度线,再用胶头滴管吸出,使液面重新达到刻度线。当液面超过刻度线时,V偏大使溶液浓度CB已变小,无论是否取出都无法使溶液恢复,只有重新配制。
②定容后盖上瓶塞,摇匀后发现液面低于刻度线,再滴加蒸馏水使液面重新达到刻度线。定容时由于少量溶液粘在瓶颈处没有回流,使液面偏低但溶液浓度未变,若再加水,则使V偏大,cB偏小。
③定容时仰视或俯视
定容时仰视,则液面高于刻度线,V偏大,cB偏小;俯视时液面低于刻度线,V偏小,cB偏大。
④移液或定容时玻璃棒下端放在容量瓶刻度线之上
会导致V偏大,cB偏小。
⑤溶液未冷却至室温即转移入容量瓶
溶解或稀释过程常伴有热效应而使溶液温度升高或降低。容量瓶的使用温度为室温(20℃),若定容时溶液温度高于室温,会使所配溶液浓度偏高;反之浓度偏低。
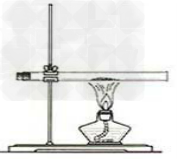
通过实验装置图判断实验的可行性:
1.红磷转换成白磷装置图
2.氨气易溶于水(喷泉实验)

3.氯化铵受热分解
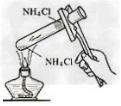
4.铵盐与碱反应
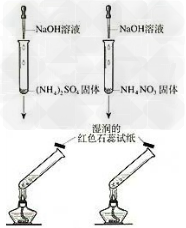
5.实验室制取氨气装置图

6.铝热反应实验装置
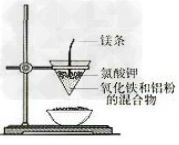
7.铁与水蒸气反应实验装置图

8.氢氧化亚铁的生成
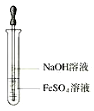
9.实验室制取乙烯的装置图
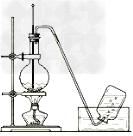
10.乙烯使高锰酸钾、溴水褪色

11.乙炔的制取和燃烧
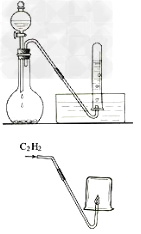
12.乙炔使溴水褪色
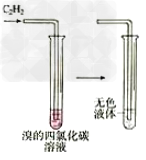
13.苯不能使高锰酸钾褪色

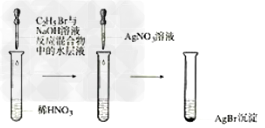
14.溴乙烷的水解反应
15.苯酚的显色反应
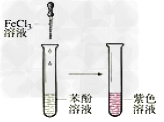
16.乙酸乙酯的制备

17.油脂的水解
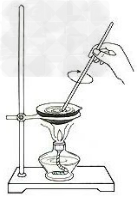
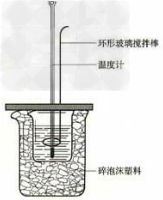
18.中和热的测定
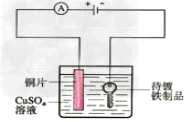
19.电镀铜实验装置
20.点解饱和食盐水
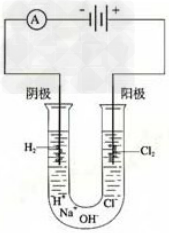
1.红磷转换成白磷装置图

2.氨气易溶于水(喷泉实验)

3.氯化铵受热分解

4.铵盐与碱反应

5.实验室制取氨气装置图

6.铝热反应实验装置

7.铁与水蒸气反应实验装置图

8.氢氧化亚铁的生成

9.实验室制取乙烯的装置图

10.乙烯使高锰酸钾、溴水褪色

11.乙炔的制取和燃烧

12.乙炔使溴水褪色

13.苯不能使高锰酸钾褪色

14.溴乙烷的水解反应

15.苯酚的显色反应

16.乙酸乙酯的制备

17.油脂的水解

18.中和热的测定

19.电镀铜实验装置

20.点解饱和食盐水

发现相似题
与“下列实验装置图及实验操作对实验现象的描述正确的是( )A....”考查相似的试题有:
- 某胶体遇盐卤(含Mg2+)或石膏易发生凝聚,而遇食盐水或Na2SO4溶液不易发生凝聚,有关解释正确的是 A.胶体微粒的直径为10-9...
- 下列说法不正确的是A.利用丁达尔现象可以鉴别胶体和溶液B.在豆浆里加入盐卤做豆腐与胶体的聚沉有关C.胶体与溶液的分离可用...
- 下列物质可用来干燥Cl2的是 ①碱石灰 ②浓硫酸 ③无水CaCl2 ④P2O5A.①②B.①③④C.②③④D.①②③④
- 用下列装置不能达到实验目的的是A.用甲图装置比较NaHCO3和Na2CO3的热稳定性B.用乙图装置制备C.用丙图装置制备并收集少量NO...
- 用浓硫酸可以干燥的气体有( )A.氨气B.氯气C.硫化氢D.碘化氢
- (14分)现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。HCOOH ...
- 不能用排水集气法收集的气体是[ ]A.O2B.HClC.H2D.NO
- 在化学实验室进行下列实验操作时,其操作或记录的数据正确的是( )A.用托盘天平称取8.84g食盐B.用220mL容量瓶配制所需的22...
- 下列装置所示的实验能达到实验目的的是[ ]A.分离碘酒中的碘和酒精B.分离沸点不同的两种互溶液体C.验证NH3的溶解性D.比较N...
- 下列实验装置的设计、试剂选用或操作正确的是( )A.除去NO中混有的NO2B.铁制品表面镀锌C.稀释浓硫酸D.制备少量O2