本试题 “已知在0.1mol•L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3).(1)该溶液中c(H+)______c(OH-)(填“>”“...” 主要考查您对盐类水解的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盐类水解的定义
盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时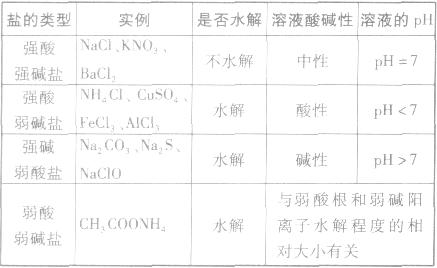
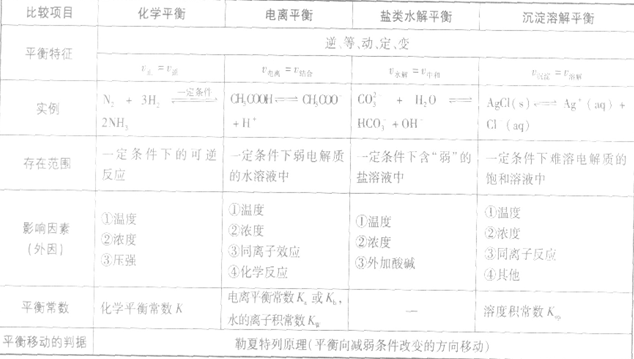
四种重要的动态平衡的比较:
发现相似题
与“已知在0.1mol•L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序...”考查相似的试题有:
- (6分)某溶液经检测只含有NH4+、Cl-、H+、OH-四种离子,(1)若该溶液中只有一种溶质,则该溶质是 (写化学式)。(2)若该...
- 把下列溶液分别蒸干后得到的固体产物仍然是原溶质的是( )A.氯化铝溶液B.碳酸氢钠溶液C.硫酸铝溶液D.氯化亚铁溶液
- 下列离子方程式正确的是( )A.硫化钠水解 S2-+2H2OH2S+2OH-B.硫氢化钠的水解 HS-+H2OH3O++S2-C.不断加热煮沸氯化铁溶液 F...
- 物质的量浓度相同的下列溶液,pH由大到小排列正确的是A.、、、B.、、、C.、、、D.、、、
- 分别设计实验,用最佳方法证明明矾溶于水时发生的下列变化:供选用的药品和仪器:明矾溶液、甲基橙试液、石蕊试液、酚酞试液...
- 对下列各溶液中,微粒的物质的量浓度关系表述正确的是A.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小...
- 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓...
- 蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁...
- 广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的...
- 已知甲、乙、丙、丁四种溶液分别为CH3COONa、NH3•H2O、CH3COOH、Na2SO4中的一种,相同温度下,甲与乙两种溶液的pH相同,甲与...