本试题 “(1)当K断开时,________上有气泡产生,生成气体对应的离子方程式为__________。(2)当K闭合时,________片上有气泡。生成气体对应的离子方程式为_________...” 主要考查您对61. 其它金属及化合物(锌、锰、钙、金等)
原电池原理
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 61. 其它金属及化合物(锌、锰、钙、金等)
- 原电池原理
锌的单质及化合物:
①单质锌:
物理性质:锌化学符号是Zn,它的原子序数是30。锌是一种蓝白色金属。密度为7.14克/立方厘米,熔点为419.5℃。在室温下,性较脆;100~150℃时,变软;超过200℃后,又变脆。锌的化学性质活泼,在常温下的空气中,表面生成一层薄而致密的碱式碳酸锌膜,可阻止进一步氧化。当温度达到225℃后,锌氧化激烈。燃烧时,发出蓝绿色火焰。锌易溶于酸,也易从溶液中置换金、银、铜等。锌的氧化膜熔点高,但金属锌熔点却很低,所以在酒精灯上加热锌片,锌片熔化变软,却不落下,正是因为氧化膜的作用。锌是第四常见的金属,仅次于铁、铝及铜。
化学性质:2Zn+O2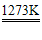 2ZnO Zn+X2
2ZnO Zn+X2 ZnX2(X=F、Cl、Br、I) 3Zn+2P
ZnX2(X=F、Cl、Br、I) 3Zn+2P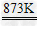 Zn3P2 Zn+S
Zn3P2 Zn+S ZnS
ZnS
②氢氧化锌 Zn2++2NaOH==Zn(OH)2+2Na+ Zn(OH)2+2H+==Zn2++H2O Zn(OH)2+2OH-==[Zn(OH)4]2- Zn(OH)2+4NH3+2NH4+==[Zn(NH3)4]2++2H2O Zn(OH)2==ZnO+H2O
[Zn(NH3)4]2++2OH-==Zn(OH)2+4NH3↑
③氯化锌 ZnO+2HCl ZnCl2+H2O ZnCl2+2H2O===Zn(OH)Cl+2HCl ZnCl2+H2O=H2[ZnCl2(OH)2] FeO+H2[ZnCl2(OH)2]==Fe[ZnCl2(OH)]2+H2O Zn+CuCl2=ZnCl2+Cu
ZnCl2+H2O ZnCl2+2H2O===Zn(OH)Cl+2HCl ZnCl2+H2O=H2[ZnCl2(OH)2] FeO+H2[ZnCl2(OH)2]==Fe[ZnCl2(OH)]2+H2O Zn+CuCl2=ZnCl2+Cu
④硫化锌 2ZnO+2S==2ZnS+O2 Zn2++(NH4)2S==ZnS+2NH4+ ZnSO4+BaS==ZnS+BaSO4 Zn2++H2S==ZnS+2H+
⑤锌的配合物(a)[Zn(NH3)4]2+、(b)[Zn(CN)4]2-
钙的单质及化合物:
①单质钙:活泼金属
②氧化钙:俗称生石灰,白色块状固体;与水反应放出大量热,块状固体变成粉末状CaO+H2O==Ca(OH)2
③氢氧化钙:俗称熟石灰,常用来检验二氧化碳气体Ca(OH)2+CO2==CaCO3↓+H2O
④碳酸钙:俗称石灰石,白色固体,不溶于水,常用的建筑材料,实验室常用其和稀盐酸反应制取二氧化碳CaCO3+2HCl==CaCl2+CO2↑+H2O
银的单质及化合物:
①物理性质:银是一种化学元素,化学符号Ag,原子序数47,是一种银白色的贵金属。银性质稳定,质软富有延展性。导热,导电率高,不易受酸碱的腐蚀
②化学性质:银的特征氧化数为+1,其化学性质比铜差,常温下,甚至加热时也不与水和空气中的氧作用。但当空气中含有硫化氢时,银的表面会失去银白色的光泽,这是因为银和空气中的H2S化合成黑色Ag2S的缘故。其化学反应方程式为: 4Ag+H2S+O2=2Ag2S+2H2O
银不能与稀盐酸或稀硫酸反应放出氢气,但银能溶解在硝酸或热的浓硫酸中:2Ag+2H2SO4(浓) Ag2SO4+SO2↑+2H2O
Ag2SO4+SO2↑+2H2O
银在常温下与卤素反应很慢,在加热的条件下即可生成卤化物:
2Ag+F2 2AgF暗棕色
2AgF暗棕色
2Ag+Cl2 2AgCl白色
2AgCl白色
2Ag+Br2 2AgBr淡黄色
2AgBr淡黄色
2Ag+I2 2AgI黄色
2AgI黄色
银对硫有很强的亲合势,加热时可以与硫直接化合成Ag2S:2Ag+S Ag2S
Ag2S
银易溶于硝酸和热的浓硫酸,微溶于热的稀硫酸而不溶于冷的稀硫酸。盐酸和王水只能使银表面发生氯化,而生成氯化银薄膜。
银具有很好的耐碱性能,不与碱金属氢氧化物和碱金属碳酸盐发生作用。
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:
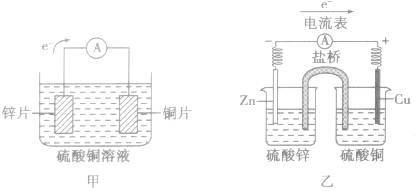
(2)原理图:
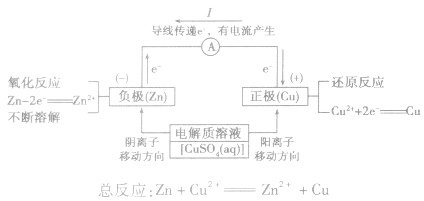
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
与“(1)当K断开时,________上有气泡产生,生成气体对应的离子...”考查相似的试题有:
- R在化学反应中常表现为+2、+4价,在溶液中R2+稳定,而R4+有强氧化性,可将NO氧化为HNO3。回答:(1)R的摩尔质量为__________...
- (10分)钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物.(1)钾和硝酸钾反应可...
- (11分)依据氧化还原反应:2Ag+(aq) + Cu(s) ="=" Cu2+(aq) + 2Ag (s)设计的原电池如图所示。请回答下列问题:(1)电极X的材...
- 铜片和锌片用导线连接后插入稀硫酸中,锌片是[ ]A.阴极B.正极C.阳极D.负极
- 下列四种装置中电解质溶液均为稀H2SO4,不属于原电池的是( )
- 碘在科研与生活中有重要应用。某兴趣小组用0.50mol/LKI、0.2%淀粉溶液、0.20mol/LK2S2O8、0.10mol/LNa2S2O3等试剂,探究反应...
- (Ⅰ)原电池是一种将______能转化为电能的装置.如图所示的原电池中,锌片上发生______反应(填“氧化”或“还原”).(Ⅱ)Li-SO...
- 化学电池在通讯、交通及日常生活中有着广泛的应用.(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为Cd+2NiO(O...
- 一学生欲通过实验判断X,Y,Z,W四块金属的活泼性, 做了如下实验并得结论:当X,Y组成原电池时,Y为负极;当Z,W组成原电池时...
- (7分)选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn + CuSO4= ZnSO4+ Cu(1)注明电极材料和电解质溶液各是什么?...