本试题 “常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+ CO2+ H2O==HA+NaHCO32NaB+CO2+H2O==2HB+ Na2CO3,则等物质的量浓...” 主要考查您对强酸和弱酸的比较
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强酸和弱酸的比较
强酸与弱酸(或强碱与弱碱)的比较:
1.强酸与弱酸(或强碱与弱碱)由于电离程度的不同,在很多方面表现出不同的性质 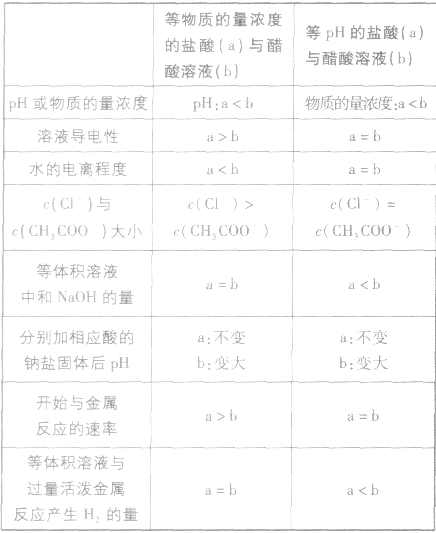
2.稀释时pH变化特点比较如下图:a、b分别为体积相等、pH相等的NaOH溶液和氨水的稀释曲线线;c、d分别为体积相等、pH相等的盐酸和醋酸溶液的稀释曲线,请体会图中的两层含义: 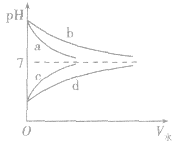
(1)加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸溶液。若稀释10n倍,盐酸、Na0H溶液pH变化n个单位,而氨水与醋酸溶液pH变化小到 n个单位。
(2)稀释后的pH仍然相等,则加水量的大小:氨水 >NaOH溶液,醋酸溶液>盐酸。
发现相似题
与“常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入...”考查相似的试题有:
- 将pH值相同的盐酸和醋酸稀溶液,分别用蒸馏水稀释至原体积时m倍和n倍后,两溶液的pH值仍然相同,则m和n的关系是[ ]A.mnC.m=nD...
- 下列各选项中所述的两个量,前者一定大于后者的是[ ]A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数B....
- 25℃时,下列有关叙述正确的是[ ]A.0.1mol/L的NaHA溶液,其pH=4,溶液中微粒浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(H...
- 今有①盐酸 ②硫酸 ③醋酸三种酸:(1)在同体积,同PH的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺...
- 取c(H+)均为0.01 mol/L的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是[ ]...
- 下列图示与对应的叙述相符的是[ ]A.图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时...
- 下列关于电解质溶液的叙述正确的是[ ]A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为 c(Cl-)>c(NH4+)>c(H+)...
- 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速...
- 同体积的1mol/L的HCl.H2SO4.CH3COOH分别加入过量的Mg。下列叙述中正确的是[ ]A.HCl.H2SO4中放出H2的速率相同B.CH3COOH中...
- 今有①CH3COOH;②HCl;③H2SO4三种溶液,(用序号填空“用>.<.=”)(1)当它们pH相同时,其物质的量浓度关系是___________...