本试题 “甲、乙、丙三种醇与足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这种醇的物质的量之比为3:6:2,则甲、乙、丙三种醇分子里羟基个数之比为[ ...” 主要考查您对单质钠
醇的通性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质钠
- 醇的通性
钠的基本性质:
钠元素的原子序数等于11,在周期表中位于第三周期,第ⅠA族。钠的原子结构示意图为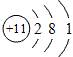 ,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
钠的物理性质:
钠单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
概括为:银白软轻低,热电良导体。
钠的化学性质:
钠的原子结构示意图为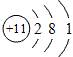 。
。
①与非金属单质的反应
A. 与氧气反应 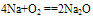 (白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因)
(白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因)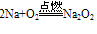 (淡黄色固体,较稳定)
(淡黄色固体,较稳定)
B. 与硫反应
2Na + S ==Na2S (研磨时发生爆炸)
C. 与氯气反应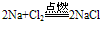
②与水反应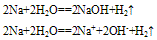
| 主要实验现象 | 对实验现象的分析 |
| 浮在水面上 | 密度比水小 |
| 熔化成闪亮的小球 | 反应放热,且钠的熔点低 |
| 迅速游动 | 反应产生气体(H2) |
| 嘶嘶作响 | 反应剧烈 |
| 溶液呈红色 | 反应生成NaOH,遇酚酞变红 |
③与盐溶液反应
钠与盐溶液反应,先考虑钠与水反应生成氢氧化钠,在考虑氢氧化钠是否与盐反应。
A. 投入NaCl溶液中,只有氢气放出。2Na+2H2O==2NaOH+H2↑
B. 投入饱和NaCl溶液中,有氢气放出,还有NaCl晶体析出(温度不变)。
C. 投入NH4Cl溶液中,有H2和NH3逸出。2Na+2NH4Cl==2NaCl+2NH3↑+H2↑
D. 投入CuSO4溶液中,有气体放出和蓝色沉淀生成。
2Na+2H2O+CuSO4==Na2SO4+Cu(OH)2↓+H2↑
如何正确取用钠?
钠具有很活泼的化学性质,易与很多物质反应,所以在取用钠时一定要注意,千万不能直接用手去拿,以免手被腐蚀,实验剩余的钠屑,绝对不可以随意丢弃,而应放回到原瓶中。
正确做法:用镊子取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察表面的颜色。实验中剩余的钠必须放回原瓶。
钠露置在空气中的一系列变化:
Na→Na2O→NaOH→Na2CO3→Na2CO3·10H2O→Na2CO3
钠的保存、制取及用途 :
①保存:由于金属钠的化学性质非常活泼,易与空气中的氧气、水蒸气反应,所以钠要保存在煤油中。
②在实验室中钠块的取用:用镊子从试剂瓶中取出钠块,用滤纸吸净表面上的煤油,在玻璃片上用小刀切去表面的氧化层,再切下一小粒备用,余下的钠全部放回试剂瓶中。
③制取:
④用途:
A. 工业上用Na作还原剂,用与冶炼金属,如4Na+TiCl4 Ti+4NaCl
Ti+4NaCl
B. Na-K合金(液态)用作原子反应堆的导热剂。
C. 在电光源上,用钠制造高压钠灯。
焰色反应:
焰色反应是化学上用来测试某种金属是否存在在化合物的方法。其原理是每种元素都有其特别的光谱,显示出不同的颜色。
焰色反应的操作:
先准备一支铂丝,钴蓝玻璃及盐或其溶液。
把铂丝浸在浓盐酸中以清除先前余下的物质,再把铂丝放在酒精灯焰(蓝色火焰)中直至没有颜色的变化。
用蒸馏水或去离子水或纯水冲洗铂丝。
用铂丝接触盐或溶液,通过酒精灯焰(蓝色火焰)中加热。
当钠离子存在于所测试的溶液中,用钴蓝玻璃过滤钠离子的焰色。
最后将观察焰色。钠的焰色为明亮的金黄色火焰。
各种元素的颜色:
| 元素符号 | 离子元素 | 名称 | 焰色 |
| Ba | Ba2+ | 钡 | 黄绿 |
| Ca | Ca2+ | 钙 | 砖红 |
| Cs | Cs+ | 铯 | 浅紫 |
| Na | Na+ | 钠 | 黄 |
| Zn | Zn2+ | 锌 | 蓝绿 |
| Fe(III) | Fe3+ | 铁(III) | 金黄 |
| K | K+ | 钾 | 浅紫(透过蓝色钴玻璃) |
| Li | Li+ | 锂 | 深红 |
碱金属元素的性质:
1.氧化产物的特殊性。碱金属在空气中燃烧,只有Li氧化生成Li2O;其余的生成过氧化物(如Na2O2)或更复杂的氧化物(如KO2)。
2.碱金属单质密度都较小,其中锂的密度是所有金属中最小的。
3.碱金属单质熔点都较低,只有Li的熔点高于100℃。
4.钾、钠在常温下为固态,但钾钠合金在常温下为液态,可作为原子反应堆的导热剂。
5.碱金属单质通常保存在煤油中,但因锂的密度小于煤油而只能保存在液体石蜡中或封存在固体石蜡中。
6.一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
7.试剂瓶中的药品取出后,一般不能放回原瓶,但ⅠA族金属Na、K等除外。
8.一般活泼金属能从盐中置换出不活泼金属,但非常活泼的金属Na、K等除外。
9.Fr是放射性元素,所以在自然界中不存在。
醇:
醇的定义:羟基跟烃基或苯环侧链上的碳原子直接相连的化合物叫做醇。
说明:在同一个碳原子上存在两个或多个羟基的多元醇,羟基连在碳碳双键或碳碳三键的不饱和碳原子上的醇,都不能稳定存在。
醇的性质:
1.醇的物理性质饱和一元醇的沸点比其相对分子质量接近的烷烃或烯烃的沸点高。这是因为一个醇分子中羟基上的氢原子可与另一个醇分子中羟基上的氧原子相互吸引形成氢键,增强了醇分子间的相互作用。
2.醇的化学性质
(1)羟基的反应
①取代反应
在加热的条件下,醇与氢卤酸(如HCl、HBr、HI)发生取代反应生成相应的卤代烃和水,例如: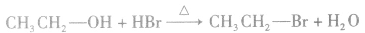
在浓硫酸作催化剂及加热的条件下,醇可以发生分子间的取代反应生成醚和水,例如: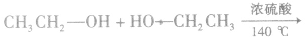
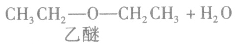
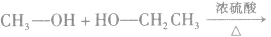

说明a.由醇生成醚的反应又叫做脱水反应或分子间脱水反应。
b.在醇生成醚的反应中,浓硫酸的作用是作催化剂和脱水剂。温度是醇脱水生成醚的必要条件之一,若温度过低,反应速率很慢或不能反应;若温度过高,反应会生成其他物质。
②消去反应
含β—H的醇,在一定条件下发生消去反应生成烯烃和水,例如: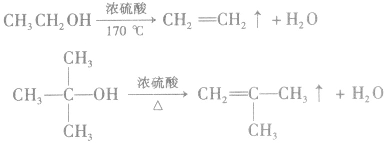
说明a.由醇生成烯烃的反应又叫做脱水反应或分子内脱水反应。
b.从分子组成与结构的方面来说,脱水生成烯烃的醇分子必须含有β一H,如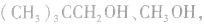 由于分子中没有β—H,不能脱水生成烯烃。
由于分子中没有β—H,不能脱水生成烯烃。
c.在醇生成烯烃的反应中,浓硫酸的作用是作催化剂和脱水剂。
d.人们通常把和官能团相连的碳原子称为α一C 原子.α—C原子上的氢原子称为α—H原子;依次称为β一C原子,β—H原子……
(2)羟基中氢原子的反应
①与活泼金属反应
由于氧元素与氢元素电负性的差异较大,羟基中氢氧键的极性比较强,容易断裂,所以羟基中的氢原子比较活泼,能与钠、钾、镁、铝等金属发生反应。例如,乙醇可以与金属钠反应生成乙醇钠和氢气。
②酯化反应
在一定条件下,醇羟基中的氢原子能够被羧酸分子中的酰基( )取代生成酯和水。
)取代生成酯和水。
例如: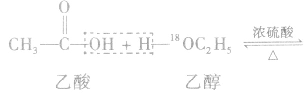

说明a.该类反应由于生成了酯,所以叫做酯化反应。从物质分子组成形式变化的角度来说,该反应又属于取代反应。
b.在乙醇与乙酸生成乙酸乙酯的反应中,利用氧同位素(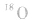 )示踪法对乙醇分子中的氧原子进行标记,通过对生成物的检测,发现产物乙酸乙酯中含有氧的同位素(
)示踪法对乙醇分子中的氧原子进行标记,通过对生成物的检测,发现产物乙酸乙酯中含有氧的同位素(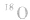 )。这说明,酯化反应中脱掉羟基的是羧酸,脱掉氢原子的是醇。
)。这说明,酯化反应中脱掉羟基的是羧酸,脱掉氢原子的是醇。
c.醇跟羧酸发生的酯化反应为可逆反应,具有反应速率慢和向右进行程度小的特点。加入浓硫酸的目的(浓硫酸的作用)有两个:一是作催化剂,提高化学反应速率;二是作吸水剂,通过吸收反应生成的水促使反应向生成乙酸乙酯的方向移动,提高乙酸与乙醇的转化率。
d.醇还能与硫酸、硝酸、磷酸等无机含氧酸发生酯化反应,生成的酯统称为无机酸酯。
(3)氧化反应大多数醇可以燃烧,完全燃烧时生成二氧化碳和水。醇也可以被催化氧化。例如: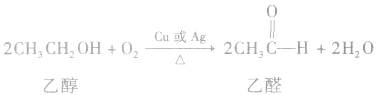
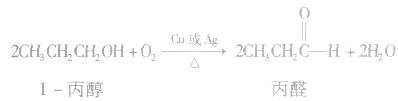
说明a.在醇的催化氧化反应中,醇分子中有2 个α一H时,醇被氧化为醛;醇分子中有1个α—H时,醇被氧化为酮;醇分子中没有α一H时,醇不能发生上述催化氧化反应。
b.乙醇也能被KMnO4酸性溶液、K2Cr2O7(重铬酸钾)酸性溶液氧化。
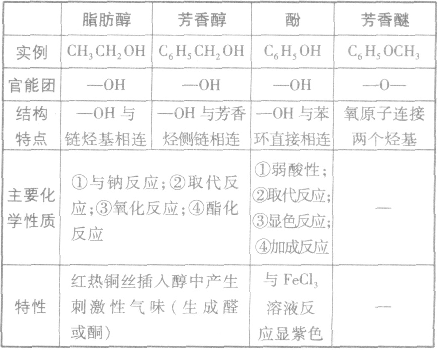
脂肪醇、芳香醇、酚和芳香醚的比较:
羟基氢原子活泼性比较:
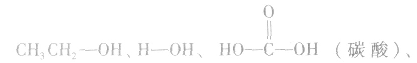
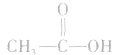 均有羟基,南于这些羟基连接的基团不同,羟基上氢原子的活泼性也就不同,现比较如下:
均有羟基,南于这些羟基连接的基团不同,羟基上氢原子的活泼性也就不同,现比较如下: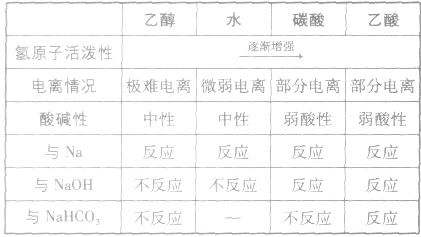
与“甲、乙、丙三种醇与足量的金属钠完全反应,在相同条件下产生...”考查相似的试题有:
- 下列有关钠的叙述正确的是( )①钠在空气中燃烧生成氧化钠 ②金属钠可以保存在煤油中③钠与硫酸铜溶液反应,可以置换出铜 ④金属...
- 金属钠长期露置于空气中,最后变为( )A.Na2OB.Na2O2C.NaOHD.Na2CO3
- 已知煤油的密度是0.8g•cm-3,试根据金属钠的保存方法和金属钠与水反应的现象推断金属钠的密度( )A.小于0.8g•cm-3B.大于1....
- 潜艇上的核反应堆使用液态铝钠合金(单质钠和单质铝熔合成)作载热介质,下列有关说法正确的是( )A.该合金的熔点介于钠、铝之...
- 下列叙述中,正确的是 ( )A.Na比K的金属性强 B.Na和K的电子层数相同C.Na和K都是强还原剂 D.Na和K灼烧时都能使火焰呈现紫色
- 下列关于合金的说法错误的是( )A.镁铝合金的熔点比镁和铝都髙B.钠钾合金作为原子反应堆导热材料主要因为其液态范围宽和比热...
- 下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是( )①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混...
- 在一密闭容器中有HCHO、H2、O2共16.5g,用电火花引燃,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重8.5g,则原...
- Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):(1)请结合化学平衡移动...
- (14分)以下四组装置在下列实验可供选择Ⅰ.实验室用甲醇催化氧化法得到甲醛,并验证甲醛的性质。请回答下列问题:(1)应选择的...