本试题 “下列说法错误的是①酸、碱、盐的组成中一定都有氢元素;②改变某饱和溶液的温度,一定会使溶液变为不饱和溶液;③任何火灾都可用水扑灭;④任何原子都必须有质子...” 主要考查您对饱和溶液,不饱和溶液
灭火的原理和方法
原子结构
酸、碱、盐
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 饱和溶液,不饱和溶液
- 灭火的原理和方法
- 原子结构
- 酸、碱、盐
饱和溶液和不饱和溶液的概念:
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液 不饱和溶液
不饱和溶液
(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水 不饱和石灰水
不饱和石灰水
概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)
溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液 饱和溶液
饱和溶液
溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)
溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液 不饱和溶液
不饱和溶液
溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
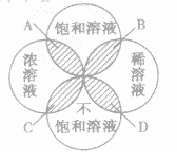 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液
 不饱和溶液
不饱和溶液(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水
 不饱和石灰水
不饱和石灰水概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液
 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液
 饱和溶液
饱和溶液溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液
 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液
 不饱和溶液
不饱和溶液溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
灭火的原理:
破坏燃烧的条件,即可达到灭火的目。
①清除可燃物或使可燃物与其他物品隔离;②隔绝氧气(或空气);③使可燃物的温度降到着火点以下。破坏燃烧的三个条件中任何一个即可达到灭火的目的。
灭火原理的实验探究:
灭火方法:
①将可燃物撤离燃烧区.与火源隔离.如液化气、煤气起火,首先要及时关闭阀门,以断绝可燃物的来源;扑灭森林火灾,可用设置隔离带的方法使森林中的树木与可燃烧区隔离
②将燃着的可燃物与空气隔离,如厨房油锅起火,盖上锅盖就能灭火;二氧化碳灭火器能火火的原因之一是灭火器喷出的大量二氧化碳在燃烧物表面形成一层二氧化碳气体层,使燃烧物与在空气隔绝,达到灭火的目的
③用大量的冷却剂(如水、干冰等)冷却可燃物,使温度降低到可燃物的着火点以下,如建筑物起火时,用高压水枪灭火等。
易错点:
灭火时降低温度不是降低着火点,着火点是物质的固有属性,一般情况下不能改变。
几种常见灭火器的灭火原理和适用范围:
泡沫灭火器的灭火原理:
1. 泡沫灭火器的灭火原理:
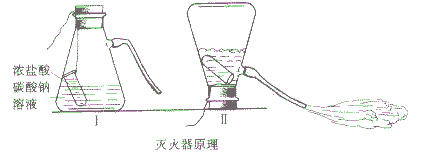
现象:当把吸滤瓶倒置后,浓HCl与Na2CO3溶液剧烈反应,产生大量CO2气体夹带着水从导管喷出。
方程式:Na2CO3+HCl==2NaCl+H2O+CO2↑(泡沫灭火原理)
2. 实际使用的泡沫灭火器,常用硫酸铝来代替盐酸(或硫酸),用碳酸氢钠来代替碳酸钠,为了产生泡沫,常放入甘草或皂角等原来制取液体。把泡沫灭火器倒转时,两种药液相互混合,发生如下反应:Al2(SO4)2+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑
大量的二氧化碳跟发泡剂形成泡沫,从喷嘴中喷射出来,覆盖在燃烧物上,使燃烧物隔绝空气和降低温度,达到灭火的目的。但是,因为泡沫中含有水分,不宜用于扑救遇水发生燃烧或爆炸的物质(如钾、钠、电石等)引起的火灾;对于电器火灾,要在切断电源后才能使用泡沫灭火器。
破坏燃烧的条件,即可达到灭火的目。
①清除可燃物或使可燃物与其他物品隔离;②隔绝氧气(或空气);③使可燃物的温度降到着火点以下。破坏燃烧的三个条件中任何一个即可达到灭火的目的。
灭火原理的实验探究:
| 实验方案 | 现象 | 分析 |
点燃三支蜡烛,在其中一支蜡烛上扣一只烧杯.将另两支蜡烛放在烧杯中,然后向其中只烧杯中加适量碳酸钠和稀盐酸如下图: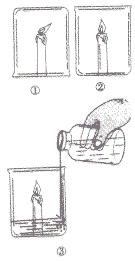 |
①在倒扣烧杯中的蜡烛熄灭 ②正放在烧杯中的蜡烛正常燃烧 ③加入适量碳酸钠和稀盐酸的烧杯中的蜡烛很快熄灭 |
①在倒扣烧杯中的蜡烛因钮气不足而熄灭 ②正放存烧杯中的蜡烛与氧气接触,温度保持在蜡烛的着火点以上,因此能正常燃烧 ⑧稀盐酸与碳酸钠迅速反应产生大量的二氧化碳气体,二氧化碳既不燃烧也不支持燃烧,所以蜡烛很快熄灭。 |
灭火方法:
①将可燃物撤离燃烧区.与火源隔离.如液化气、煤气起火,首先要及时关闭阀门,以断绝可燃物的来源;扑灭森林火灾,可用设置隔离带的方法使森林中的树木与可燃烧区隔离
②将燃着的可燃物与空气隔离,如厨房油锅起火,盖上锅盖就能灭火;二氧化碳灭火器能火火的原因之一是灭火器喷出的大量二氧化碳在燃烧物表面形成一层二氧化碳气体层,使燃烧物与在空气隔绝,达到灭火的目的
③用大量的冷却剂(如水、干冰等)冷却可燃物,使温度降低到可燃物的着火点以下,如建筑物起火时,用高压水枪灭火等。
易错点:
灭火时降低温度不是降低着火点,着火点是物质的固有属性,一般情况下不能改变。
几种常见灭火器的灭火原理和适用范围:
| 灭火器 | 灭火原理 | 适用范围 |
| 泡沫灭火器 | 灭火时.能喷射出大量二氧化碳及泡沫,它们能黏附在可燃物上,使可燃物与空气隔绝,达到灭火的目的 | 可用来扑灭木材、棉布等燃烧引起的灭火 |
| 利用压缩的二氧化碳吹出干粉(主要含有碳酸氧钠)来灭火 | 具有流动性好,喷射率高、不腐蚀容器和不易变质等优良性能,除可用来扑灭一般失火外,还可用来扑灭油、气等燃烧引起的失火 | |
| 在加压时将液态二氧化碳压缩在小钢瓶中,灭火时再将其喷出,有降温和隔绝空气的作用 | 火火时不会因留下任何痕迹而使物体损坏.因此可用来扑灭图书、档案、贵重设备、精密仪器等处的失火.使用时,手一定要先握在钢瓶的木柄上,否则.会把手冻伤。 |
泡沫灭火器的灭火原理:
1. 泡沫灭火器的灭火原理:

现象:当把吸滤瓶倒置后,浓HCl与Na2CO3溶液剧烈反应,产生大量CO2气体夹带着水从导管喷出。
方程式:Na2CO3+HCl==2NaCl+H2O+CO2↑(泡沫灭火原理)
2. 实际使用的泡沫灭火器,常用硫酸铝来代替盐酸(或硫酸),用碳酸氢钠来代替碳酸钠,为了产生泡沫,常放入甘草或皂角等原来制取液体。把泡沫灭火器倒转时,两种药液相互混合,发生如下反应:Al2(SO4)2+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑
大量的二氧化碳跟发泡剂形成泡沫,从喷嘴中喷射出来,覆盖在燃烧物上,使燃烧物隔绝空气和降低温度,达到灭火的目的。但是,因为泡沫中含有水分,不宜用于扑救遇水发生燃烧或爆炸的物质(如钾、钠、电石等)引起的火灾;对于电器火灾,要在切断电源后才能使用泡沫灭火器。
原子的构成:

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的 。
。
质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的
 。
。质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
酸:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
| 从化学组成看 | 从电离观点看 | 组成特点 | |
| 酸 | 由氢元素和酸根组成 | 电离时生成的阳离子全都是氢离子(H+)的化合物 | 一定含氢元素 |
| 碱 | 由金属元素和氢氧根组成(氨水也是碱) | 电离时生成的阴离子全都是氢氧根离子(OH-)的化合物 | 一定含氢、氧 元素 |
| 盐 | 含有金属元素(或NH4+) 和酸根 | 电离时能生成金属离子(或NH4+)和酸根离子的化合物 | 酸式盐中一定含氢元素,碱式盐中一定含氢、氧元素 |
发现相似题
与“下列说法错误的是①酸、碱、盐的组成中一定都有氢元素;②改变...”考查相似的试题有:
- 溶解度曲线中的任何一点都表示溶液的一种特定状态.当溶液状态发生变化时,表示溶液状态的点的位置(坐标)也将发生相应的改...
- 欲使任意一种不饱和溶液转变为饱和溶液,最可靠的方法是[ ]A、降温B、升温C、加溶质D、倒出一些溶液
- 下列物质中不属于溶液的是A.碘酒B.啤酒C.蒸馏水D.眼药水
- 下列关于燃烧和灭火的说法中,错误的是[ ]A.热水中的白磷不燃烧是因为没有跟氧气接触B.木炭在纯净的氧气中燃烧比在空气中更旺...
- 下列做法错误的是( )A.消防队员用高压水降低可燃物的温度进行灭火B.炒菜时油锅着火可以用锅盖迅速盖灭C.室内着火时,立...
- 对山林发生的重大火灾,下列方法适合的是[ ]A. 砍掉或清理掉大火前面的干枯树枝、树叶等可燃物B. 组织人力从山下运水到山上灭...
- 下列关于原子核的叙述中,正确的是( )①通常由中子和电子构成 ②通常由质子和中子构成 ③带负电荷 ④不显电性⑤不能再分 ⑥体...
- 直到19世纪末,人们一直认为原子是不可再分的.但是后来通过汤姆生发现电子的实验,人们才知道原子还可以再分成更小的粒子....
- 实验室有以下几种物质:金刚石、生铁、氧化铝、氢氧化钾、醋酸、酒精.请按要求写出有关物质的化学式.属于单质的是______;...
- 在化学学习过程中,常常要用到分类的方法。下列各组物质的分类正确的是[ ]A.混合物:空气 粗盐 牛奶B.盐:氯化钙 硫酸 硝酸...