本试题 “请用“<”“>”或“=”填空.(1)pH:NaCl溶液______水;(2)20℃时熟石灰的溶解度______50℃时熟石灰的溶解度;(3)37%的浓盐酸敞口放置于空气中一段时间后,溶...” 主要考查您对固体溶解度
合金
酸的性质
溶液的酸碱性与pH值
酸的用途
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 固体溶解度
- 合金
- 酸的性质
- 溶液的酸碱性与pH值
- 酸的用途
概念:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)
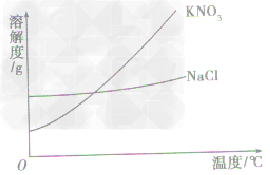
(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)

(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
合金的概念:
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类
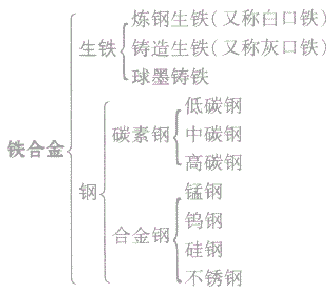
(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
| 含碳量 | 2%—4% | 0.03%—2% |
| 其他元素 | Si、Mn、S、P(少量) | Si、Mn等 |
| 机械性能 | 硬而脆,无韧性 | 坚硬,韧性大,塑性好,有弹性 |
| 机械加工性质 | 可铸不可锻 | 可铸,可锻,可压延 |
| 分类 | 白口铁,灰口铁,球墨铸铁 | 碳素钢,合金钢 |
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类

(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
定义:
化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
酸的通性:
(1)跟指示剂反应 紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色
(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气 例:2HCl+Fe=FeCl2+H2↑
(3)跟碱性氧化物反应酸+碱性氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(4)跟某些盐反应酸+盐→新酸+新盐 H2SO4+BaCl2=2HCl+BaSO4↓
(5)跟可溶性碱发生中和反应酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+2H2O
常见酸的性质:
(1)盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口
立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形
成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。稀H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
①吸水性: 浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂: 浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:
在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并且体积膨胀。又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生大量酸雾,可用此法制得氯化氢气体。
(3)硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
硝酸除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
浓H2SO4为什么能做干燥剂:
因为浓H2SO4有强烈的吸水性,当它遇到水分子后,能强烈地和水分子结合,生成一系列水合物。这些水合物很稳定,不易分解,所以浓H2SO4是一种很好的干燥剂,能吸收多种气体中的水蒸气,实验室常用来干燥酸性或中性气体。如:CO2,SO2,H2,O2可用浓H2SO4干燥,但碱性气体如:NH3不能用浓H2SO4来干燥。
为什么浓H2SO4能用铁槽来运输:
当铁在常温下和浓H2SO4接触时,它的表面能生成一层致密的氧化膜,这层氧化膜能阻止浓H2SO4;对铁的进一步腐蚀,这种现象叫钝化。
活泼金属能置换出浓H2SO4中的氢吗?
稀H2SO4具有酸的通性,活泼金属能置换出酸中的氢。而浓H2SO4和稀H2SO4的性质不同,活泼金属与浓H2SO4反应时,不能生成氢气,只能生成水和其他物质,因为它具有强氧化性。
敞口放置的浓硫酸.浓盐酸.浓硝酸的变化:
胃酸:
在人的胃液里,HCl的溶质质最分数为0.45%— 0.6%,胃酸是由胃底腺的壁细胞分泌的。它具有以下功能:
(1)促进胃蛋白酶的催化作用,使蛋白质在人体内容易被消化,吸收;(2)使二糖类物质如蔗糖、麦芽糖水解;(3)杀菌。
酸的分类和命名
1.酸根据组成中是否含氧元素可以分为含氧酸和无氧酸。如:盐酸(HCl)属于无氧酸,硫酸(H2SO4)、硝酸(HNO3)属于含氧酸。
2.酸还可以根据每个酸分子电离出的H+个数,分为一元酸、二元酸、多元酸。如:每分子盐酸、硝酸溶于水时能电离出一个H+,属于一元酸;每分子硫酸溶于水时能电离出两个H+,属于二元酸。
3.无氧酸一般从前往后读作“氢某酸”。如:HCl读作氢氯酸(盐酸是其俗名),H2S读作氢硫酸。
4.含氧酸命名时一般去掉氢、氧两种元素,读作 “某”酸。如:H2SO4命名时去掉氢、氧两种元素,读作硫酸,H3PO4读作磷酸。若同一种元素有可变价态,一般低价叫“亚某酸”。如:H2SO3读作亚硫酸,HNO2读作亚硝酸。
化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
酸的通性:
(1)跟指示剂反应 紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色
(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气 例:2HCl+Fe=FeCl2+H2↑
(3)跟碱性氧化物反应酸+碱性氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(4)跟某些盐反应酸+盐→新酸+新盐 H2SO4+BaCl2=2HCl+BaSO4↓
(5)跟可溶性碱发生中和反应酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+2H2O
常见酸的性质:
(1)盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口
立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形
成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。稀H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
①吸水性: 浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂: 浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:
在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并且体积膨胀。又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生大量酸雾,可用此法制得氯化氢气体。
(3)硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
硝酸除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
浓H2SO4为什么能做干燥剂:
因为浓H2SO4有强烈的吸水性,当它遇到水分子后,能强烈地和水分子结合,生成一系列水合物。这些水合物很稳定,不易分解,所以浓H2SO4是一种很好的干燥剂,能吸收多种气体中的水蒸气,实验室常用来干燥酸性或中性气体。如:CO2,SO2,H2,O2可用浓H2SO4干燥,但碱性气体如:NH3不能用浓H2SO4来干燥。
为什么浓H2SO4能用铁槽来运输:
当铁在常温下和浓H2SO4接触时,它的表面能生成一层致密的氧化膜,这层氧化膜能阻止浓H2SO4;对铁的进一步腐蚀,这种现象叫钝化。
活泼金属能置换出浓H2SO4中的氢吗?
稀H2SO4具有酸的通性,活泼金属能置换出酸中的氢。而浓H2SO4和稀H2SO4的性质不同,活泼金属与浓H2SO4反应时,不能生成氢气,只能生成水和其他物质,因为它具有强氧化性。
敞口放置的浓硫酸.浓盐酸.浓硝酸的变化:
| 酸的名称 | |||||
| 浓盐酸 | 挥发性 | 变小 | 不变 | 变小 | 变小 |
| 浓硫酸 | 挥发性 | 变小 | 不变 | 变小 | 变小 |
| 浓硝酸 | 吸水性 | 不变 | 变大 | 变大 | 变小 |
胃酸:
在人的胃液里,HCl的溶质质最分数为0.45%— 0.6%,胃酸是由胃底腺的壁细胞分泌的。它具有以下功能:
(1)促进胃蛋白酶的催化作用,使蛋白质在人体内容易被消化,吸收;(2)使二糖类物质如蔗糖、麦芽糖水解;(3)杀菌。
酸的分类和命名
1.酸根据组成中是否含氧元素可以分为含氧酸和无氧酸。如:盐酸(HCl)属于无氧酸,硫酸(H2SO4)、硝酸(HNO3)属于含氧酸。
2.酸还可以根据每个酸分子电离出的H+个数,分为一元酸、二元酸、多元酸。如:每分子盐酸、硝酸溶于水时能电离出一个H+,属于一元酸;每分子硫酸溶于水时能电离出两个H+,属于二元酸。
3.无氧酸一般从前往后读作“氢某酸”。如:HCl读作氢氯酸(盐酸是其俗名),H2S读作氢硫酸。
4.含氧酸命名时一般去掉氢、氧两种元素,读作 “某”酸。如:H2SO4命名时去掉氢、氧两种元素,读作硫酸,H3PO4读作磷酸。若同一种元素有可变价态,一般低价叫“亚某酸”。如:H2SO3读作亚硫酸,HNO2读作亚硝酸。
溶液的酸碱度及表示方法
1. 溶液的酸碱性:溶液呈酸性、碱性或中性,通常用指示剂来测定。
2. 溶液的酸碱度:指溶液酸碱性的强弱程度,即酸碱度是定量表示溶液酸碱性强弱的一种方法.溶液的酸碱度通常用pH表示。
3. pH的范围:0—14
溶液酸碱度和pH值的关系
| 溶液的pH值 | 溶液的酸碱度 |
| <7 | 酸性溶液(pH越小,酸性越强) |
| =7 | 中性溶液 |
| >7 | 碱性溶液(pH越大,碱性越大) |
(2)粗略测定溶液的酸碱度常用pH试纸。
pH的测定方法:
测定溶液pH通常用pH试纸和pH计。其中用pH试纸测定溶液pH的具体操作为:测定时,将pH试纸放在表面皿上,用干净的玻璃棒蘸取被测溶液并滴在pH试纸上,半分钟后把试纸显示的颜色与标准比色卡对照,读出溶液的pH,简记为:“一放、二蘸、三滴、四比”。
改变溶液pH的方法:
溶液的pH实质是溶液中H+浓度或OH-浓度大小的外在表现。改变溶液中H+浓度或OH-浓度,溶液的pH就会发生改变。
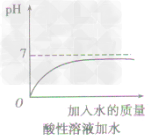
方法一加水:只能改变溶液的酸碱度,不能改变溶液的酸碱性,即溶液的pH只能无限地接近于7。
①向酸性溶液中加水,pH由小变大并接近7,但不会等于7,更不会大于7(如下图所示)。
②向碱性溶液中加水,pH由大变小并接近于7,但不会等于7,更不会小于7(如下图所示)。

方法二加酸碱性相同,pH不同的溶液:原溶液酸碱性不会发生变化,但混合后溶液的pH介于两种溶液之间:
方法三加酸碱性相反的溶液:混合后发生中和反应,溶液的pH可能等于7,若加入的溶液过量,原溶液的酸碱性就会与原来相反(如下图所示)。

pH值测定时的注意事项:
①不能直接把pH试纸浸入待测的溶液中,以免带入杂质,同时还可能溶解pH试纸上的一部分指示剂,致使比色时产生较大误差。
②不能先用水将pH试纸润湿再进行测定。因为将待测溶液滴到用水润湿后的pH试纸上,其溶质质量分数将变小。
③用pH试纸测得溶液的pH一般为整数。
了解溶液的酸碱度的重要意义:
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中.农作物一般适宜在pH为7或接近于7的土壤中生长;
③测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况;
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
身边一些物质的pH:

酸的用途很广泛:
1. 盐酸:用于金属表面除锈,制造药物等,人体胃液中含有盐酸帮助消化。
2. 硫酸:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油等;实验室常用作干燥剂。
3. 硝酸:主要应用于制造化肥,以及硝酸盐工业。
4. 醋酸:生活中既可作食品调味,也可用于清洗热水瓶内水垢。
1. 盐酸:用于金属表面除锈,制造药物等,人体胃液中含有盐酸帮助消化。
2. 硫酸:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油等;实验室常用作干燥剂。
3. 硝酸:主要应用于制造化肥,以及硝酸盐工业。
4. 醋酸:生活中既可作食品调味,也可用于清洗热水瓶内水垢。
发现相似题
与“请用“<”“>”或“=”填空.(1)pH:NaCl溶液______水;(2)20...”考查相似的试题有:
- 如图是M、N两种物质的溶解度曲线,在t1℃时,往盛有100g水的烧杯中,先后加入agM和bgN(两种物质溶解时互不影响,且溶质仍是M...
- 根据下表数据回答问题:温度(℃)01020406080100NaOH溶解度(g/100g水)4251109129174314347A溶解度(g/100g水)0.180.170.16...
- 物质M在不同温度下的溶解度数据如下表所示,以下说法正确的是( ) 温度(℃) 0 20 40 60 80 溶解度(g) 12.6 15.3 20.0 25....
- 钢铁是重要的金属材料.(1)下列铁制品中,制造铁丝利用了铁的性质是______.(2)目前世界上已有50%以上的废钢铁得到回收利...
- 有一溶液 X,分别滴加到盛有氯化铁、碳酸钠、硫酸镁溶液的试管中并振荡,产生的现象如下表,则溶液 X 是试管中盛放物质氯化铁...
- 小明同学在实验中发现了一个问题:在碳酸钠溶液中滴加硝酸银溶液后产生了白色沉淀,再滴加稀硝酸后观察到的现象与预想的不一...
- 肖伟同学接到老师交给的任务:除去氯化钙中混有的氯化铵和碳酸钙,他的除杂方案正在设计中,请你帮助他完成设计:实验步骤实...
- 下表为家庭中一些常见物质的pH物质食醋牙膏食盐水肥皂水火碱液pH3971013有些昆虫如蜂、蚂蚁等叮咬人时,会向人体射入一种叫蚁...
- 下图是生活中一些物质的pH,下列说法中正确的是[ ]A.酱油呈碱性B.肥皂水能使无色酚酞试液变红C.胃酸过多的人适宜多喝玉米...
- 自来水是我国目前生活饮用水,下表是我国颁布的生活饮用水水质标准的部分内容.项目标准感官指标无异味、异臭等化学指标pH6.5...