本试题 “Cu在有O2存在的条件下可与热的稀H2SO4反应生成CuSO4,其反应方程式为____。 用含有铁屑、铝屑的废铜屑为原料制备胆矾,其主要步骤是____。” 主要考查您对单质铜
铜盐(二价铜)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铜
- 铜盐(二价铜)
铜元素:
在元素周期表中的位置:铜的原子序数29,位于周期表中第四周期,第IB族。
(1)物理性质:有金属光泽,紫红色固体,密度较大,导电导热性能很好,具有很好的延展性,铜属于重金属、有色金属、常见金属,不能被磁铁吸引。
(2)化学性质: 铜常见的化合价为+1价和+2价
①在加热条件下,铜可与多种非金属单质反应。一般来说,遇到氧化性较弱的非金属,铜显较低化合价;遇到氧化性较强的非金属,铜显较高化合价。例如:与强氧化剂反应(如Cl2 Br2等)生成+2价铜的化合物。如:
Cu+Cl2 CuCl2 2Cu+O2
CuCl2 2Cu+O2 2CuO
2CuO
②铜与酸反应:铜只能被氧化性酸中的中心元素氧化。例如: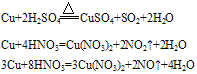
③铜与盐溶液反应:
Cu+2AgCl CuCl2+2Ag
CuCl2+2Ag
铜与铁的对比:
从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au可知,金属铁的金属活性比铜强,所以单质Fe可以从Cu的溶液中还原出单质来,例如: Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
即Fe的还原性强于Cu
铜与浓硫酸和稀硫酸的反应:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
注意:从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 可知,铜不能与稀硫酸发生反应,但是在有氧气和加热的条件下可以反应
铜与铜的化合物之间的转换图: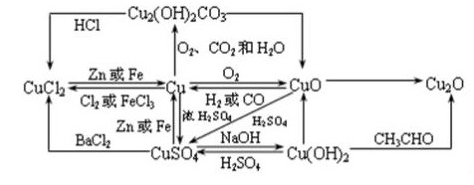
铜的制备和精炼:
(1)工业炼铜法:CuO+CO Cu+CO2
Cu+CO2
(2)湿法炼铜:Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
(3)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
备注:粗铜中铜的的含量为99.5%-99.7%,主要含有Ag、Zn、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%-99.98%的铜,原理为用粗铜作阳极,失去电子变为Cu2+,用纯铜棒作阴极即可得精铜。
硫酸铜:
五水合硫酸铜(CuSO4·5H2O)为天蓝色晶体,水溶液呈弱酸性,俗名胆矾或蓝矾。硫酸铜是制备其他铜化合物的重要原料。同石灰乳混合可得波尔多液,用作杀菌剂。硫酸铜也是电解精炼铜时的电解液。
硫酸铜的物理性质和化学性质:
(1)物理性质:白色粉末状固体,不溶于乙醇和乙醚,易溶于水,水溶液呈蓝色,是强酸弱碱盐,水溶液呈弱酸性。将硫酸铜溶液浓缩结晶,可得五水硫酸铜蓝色晶体,俗称胆矾、铜矾或蓝矾。
(2)化学性质:
①二价铜与碱反应生成蓝色沉淀Cu(OH)2,Cu(OH)2溶于氨水形成深蓝色溶液[Cu(NH3)4]2+,此性质可以检验Cu2+。无水硫酸铜遇水变成蓝色(CuSO4·5H2O),可作为水的检验的依据。
②胆矾在常温常压下很稳定,不潮解,在干燥的空气中会逐渐风化(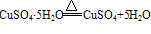 ),加热到45℃时失去2分子结晶水,110℃时失去4分子结晶水,150℃失去全部结晶水。将胆矾加热至650℃高温,可分解为黑色氧化铜、二氧化硫和氧气。
),加热到45℃时失去2分子结晶水,110℃时失去4分子结晶水,150℃失去全部结晶水。将胆矾加热至650℃高温,可分解为黑色氧化铜、二氧化硫和氧气。
(3)Cu2+的化学性质:能被活泼金属将其从盐溶液中置换出来:例:Cu2++Fe==Cu+Fe2+
硫酸铜的用途和制法:
(1)用途:硫酸铜较重要的铜盐之一,在电镀、印染、颜料、农药等方面有广泛的应用。无机农药波尔多液就是硫酸铜和消石灰的混合液,是一种良好的杀菌剂,可防止多种作物的病害。硫酸铜也常用来制备其他铜的化合物和电解精炼铜的电解液。
(2)制法:五水合硫酸铜可由铜或氧化铜与硫酸作用后,浓缩结晶而制得。在实验室中可用浓硫酸氧化金属铜来制取无水硫酸铜。
与“Cu在有O2存在的条件下可与热的稀H2SO4反应生成CuSO4,其反应...”考查相似的试题有:
- I.某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO3-、NO3-。已知该溶液可与Al2O3反应,则:(1)...
- 下列反反应发生时,会产生红棕色烟的是[ ]A.钠在氯气中燃烧B.铜在氯气中燃烧C.氢气在氯气中燃烧D.铁在氯气中燃烧
- 在Fe , Cu的混合物中加入一定量的稀硝酸并微热,充分反应后剩余金属a克。再向其中加入一定量的稀盐酸并加热,充分振荡后还剩...
- 氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应,用CuSO4溶液和“某物质”在40-50℃时反应可产生它.下列有关...
- 制印刷电路时常用氯化铁溶液作“腐蚀液”,发生的化学反应为2FeCl3+Cu==2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜...
- 把一段弯曲成螺旋状的铜丝放在酒精灯火焰上加热,铜丝表面生成一薄层____色的_____,反应的化学方程式是____________________...
- 有关下列实验的说法中正确的是( ) A.向苯酚的浓溶液中加入少量稀溴水,可观察到有白色沉淀生成 B.向氯化铝溶液中加足量的...
- 将Zn加入到含有Fe2+,Cu2+,Ag+,Al3+等离子的溶液中,最先被置换出来的单质是[ ]A.FeB.CuC.AgD.Al
- 已知酸性条件下有反应:2Cu+= Cu2++Cu。氢气还原氧化铜实验由于反应温度不同,产物可能不同。下表为在红色的还原产物中加入试...
- 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是[ ]A.图1实...