本试题 “金属及其化合物在生产、生活中有广泛应用.请回答下列问题:(1)工业上常利用Fe2+能与CN-形成稳定Fe(CN)4-6(六氰合亚铁离子)的特点来处理含CN-的工业废...” 主要考查您对配合物理论
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 配合物理论
配位键、配合物:
1.配位键配位键是一种特殊的共价键。成键的两个原子间的共用电子对是由一个原子单独提供的。形成配位键的条件是其中一个原子有孤电子对,另一个原子有接受孤电子对的“空轨道”。配位键用A→B表示,A是提供孤电子对的原子,B是接受孤电子对的原子。
2.配合物通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配合物。
3.配位键的形成
(1) 中配位键的形成
中配位键的形成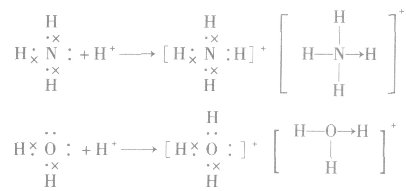
注意:结构式中“→”表示配位键及其共用电子对的提供方式。
(2)配离子 中配位键的形成
中配位键的形成
在 里,NH3分子中的氮原子给出孤电子对,
里,NH3分子中的氮原子给出孤电子对,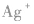 接受电子对,以配位键形成了
接受电子对,以配位键形成了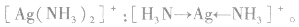
(3)配离子 的形成
的形成
在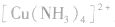 里,
里, 分子中的氮原子给出孤电子对,
分子中的氮原子给出孤电子对, 接受电子对,以配位键形成了
接受电子对,以配位键形成了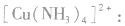
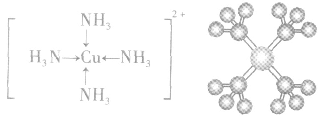
4.配合物的组成
配合物的组成包含中心原子、配体和配位原子、配位数,内界和外界等。以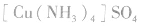 为例说明,如下图所示:
为例说明,如下图所示: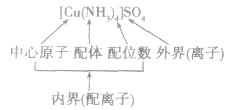
配合物的内界和外界之间多以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离但程度非常小,可谓“强中有弱”。例如,配合物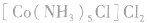 溶液中加入
溶液中加入 溶液,外界的
溶液,外界的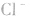 能被沉淀,而内界的
能被沉淀,而内界的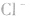 不能形成沉淀。
不能形成沉淀。
发现相似题
与“金属及其化合物在生产、生活中有广泛应用.请回答下列问题:...”考查相似的试题有:
- 前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少...
- Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。(1)[Cu(NH3)4]2+中存在的化学键类型有________(填序号)。A.配位键 B.极性...
- 一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4•H2O]是一种重要的染料及农药中间体.请回答下列相关问题:(1)Cu的核外电子排布式...
- 具有6个配体的Co3+的配合物CoClm·nNH3,若1 mol配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是 [ ]A.m=1,n=5B.m=3,n...
- [化学--选修物质结构与性质]已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有...
- (1)金属钛(22Ti)将是继铜、铁、铝之后被人类广泛使用的第四种金属,请写出钛的基态原子的电子排布式:____ 。(2)二氧化钛可作...
- [三选一—选修3:物质结构与性质]第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。(1)①H、C、N、O四种元素的电负性由...
- (1)图表法、图象法是常用的科学研究方法。短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第_______族。...
- 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。...
- 关于配合物[Zn(NH3)4]Cl2的说法正确的是[ ]A.配位数为6B.配体为NH3和Cl-C.[Zn(NH3)4]2+为内界D.Zn2+和NH3以离子键结合