本试题 “如图所示是实验室制取二氧化碳及验证二氧化碳性质的改进实验,下列说法中正确的是[ ]A.粗铜丝换成铁丝对实验没有影响B.浸有紫色石蕊试液的棉花会变成蓝色C...” 主要考查您对二氧化碳的制取和收集
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化碳的制取和收集
二氧化碳的制取和收集:
1.原理和药品:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
2.装置:固液混合不加热
(1)发生装置
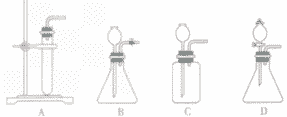
A装置为简易装置,不便于加液体;
B,C使用了长颈漏斗,便于添加液体,使用B、C装置时应注意,长颈漏斗下端管日应伸入液面以下,防止产生的气体从长颈漏斗逸出;
D装置使用了分液漏斗,便于加酸,还可以利用活塞控制反应。
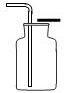
(2)收集装置:二氧化碳溶于水,所以不能用排水法收集;其密度比空气大,所以可采用向上排空气法收集。
如图:
3.现象:块状固体不断溶解,产生大量气泡。
4.检验:把产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明是二氧化碳。
5.验满:将燃着的木条放在集气瓶口,如果木条的火焰熄灭,证明已集满。
6.实验步骤
a.检查装置的气密性;
b.装入石灰石(或大理石);
c. 塞紧双孔塞;
d.从长颈漏斗中加入稀盐酸;
e.收集气体;
f.验满。
7.注意事项:反应物不能用浓盐酸、硫酸、因为浓盐酸易挥发,会挥发出氯化氢气体,使制得的二氧化碳不纯;硫酸不会挥发,但会生成硫酸钙沉淀,沉淀的硫酸根附着在碳酸钙(或石灰石)表面,使碳酸钙(或石灰石)与酸的接触面积变小,最后反应停止!
实验室制取二氧化碳的选择:
实验室用大理石或石灰石(主要成分是碳酸钙)和稀盐酸制取二氧化碳。
注意:
(1)不能选用稀硫酸,因为稀硫酸与碳酸钙反应生成微溶于水的硫酸钙会橙盖在碳酸钙的表面,阻止反应继续进行。
(2)不能选用浓盐酸,因为浓盐酸易挥发,得不到纯净的二氧化碳气体。
(3)不能用碳酸钠代替石灰石,因为反应太剧烈,产生的气体难以收集。反应速率的快慢与反应物的质量分数和接触面积有关。反应物的接触面积越大,反应物的质量分数越大,反应速率就越快,反之,则越慢。
各组物质反应情况如下表所示:
| 药品 | 反应速率 |
| 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| 石灰石粉末和稀盐酸 | 产生气泡速率很快 |
| 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
发现相似题
与“如图所示是实验室制取二氧化碳及验证二氧化碳性质的改进实验...”考查相似的试题有:
- 现有实验室的部分仪器或装置,如图所示,请你回答下列问题:(1)若要组装成一套制取二氧化碳的发生装置,可选用图中的______...
- 如图所示,这是一瓶用排水法收集好的无色气体。据此,请你写出与这种气体相关的物理性质(“无色气体”除外):_______________...
- 下图是实验室制取二氧化碳的装置,据此装置图回答下列问题:(1)装置中仪器的名称:a______,b______,c______,d______.(...
- (2011年四川眉山,20题)通过一年的化学学习,你已经掌握了实验室制取气体的一些规律,以下是老师提供的一些实验装置,请你...
- 如图是实验室常用的装置.请根据图回答下列问题:(1)写出带有标号仪器的名称:① (2)实验室用高锰酸钾制取氧气的化学方程...
- 下列实验室制取气体的药品正确的是( )A.硫酸和大理石制二氧化碳B.稀盐酸和大理石制二氧化碳C.加热高锰酸钾制氧气D.电解...
- 下图是某化学兴趣小组设计的CO2的制取和性质探究实验的示意图。据图完成下列各题。(1)装置C的作用是(化学方程式)________...
- 请根据下图回答问题:(1)仪器A的名称是 ,仪器B的名称是 。(2)用KClO3与MnO2混合制取和收集纯净O2,应选用上图中的 (填...
- 下图是常见的气体发生装置和收集装置。(1)写出下列指定序号所指仪器的名称: ① ;③ ;④ ;(2)实验室用高锰酸钾晶体制取氧气的...
- 实验室制取O2、H2、CO2三个实验中均需使用的仪器是( )A.集气瓶B.漏斗C.烧杯D.洒精灯