本试题 “关于结构如图所示的有机物的叙述中正确的是( ) A.1mol此有机物与足量Na发生反应,有3molH2生成 B.分子中有3个手性碳原子 C.分子中sp2、sp3杂化的原子个...” 主要考查您对手性(手性碳原子)
杂化轨道理论(中心原子杂化方式)
有机物分子的空间构型
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 手性(手性碳原子)
- 杂化轨道理论(中心原子杂化方式)
- 有机物分子的空间构型
手性碳原子、手性异构体与手性分子:
1.手性碳原子
连接四个不同原子或基团的碳原子,称为手性碳原子,常用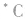 表示。如下图所示。
表示。如下图所示。
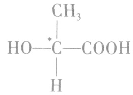
2.手性异构体
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,但在三维空间里不能重叠,这对分子互称为手性异构体。
3.手性分子
有手性异构体的分子叫做手性分子。
4.分子是否表现手性的判断
具有手性的有机物,是因为其含有手性碳原子。所以,判断一种有机物是否具有手性异构体,就看其是否含有连有四个不同的原子或基团的碳原子。
杂化轨道理论:
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
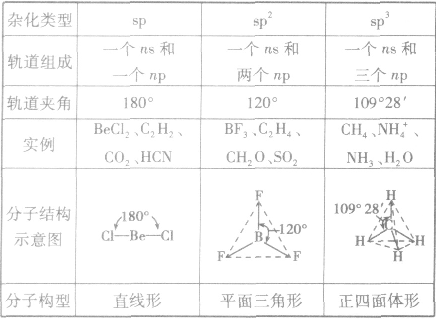
有机物分子的空间构型:
(1)烷、烷基:
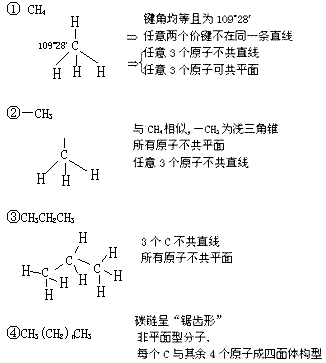
(2)烯:
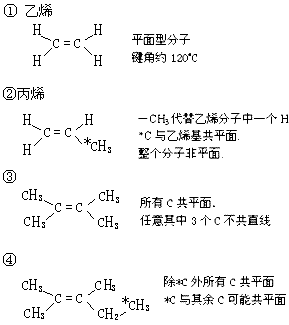
(3)醛、酮、羧酸
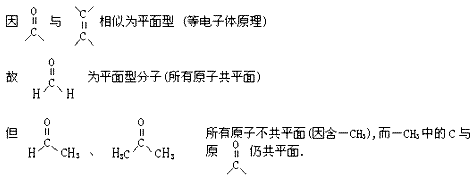
(4)苯、苯的同系物,稠环芳烃
苯是一种平面型分子,当苯环上的H被其它某个原子取代后仍为平面型。当取代基为非平面型,整个分子也就变为非平面型。
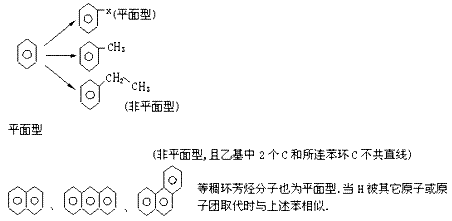
(5)炔:因为C2H2为一种直线型分子:H-C≡C-H。所以它的卤代物C2HX、C2X2均为直线型分子:H-C≡C-X、
X-C≡C-X,丙炔CH3-C≡C-H分子中3个C和乙炔基中H共直线整个分子非直线也非平面型(含-CH3)
(1)烷、烷基:

(2)烯:

(3)醛、酮、羧酸

(4)苯、苯的同系物,稠环芳烃
苯是一种平面型分子,当苯环上的H被其它某个原子取代后仍为平面型。当取代基为非平面型,整个分子也就变为非平面型。

(5)炔:因为C2H2为一种直线型分子:H-C≡C-H。所以它的卤代物C2HX、C2X2均为直线型分子:H-C≡C-X、
X-C≡C-X,丙炔CH3-C≡C-H分子中3个C和乙炔基中H共直线整个分子非直线也非平面型(含-CH3)
发现相似题
与“关于结构如图所示的有机物的叙述中正确的是( ) A.1mol此有...”考查相似的试题有:
- (三选一)【物质结构与性质】原子序数依次递增的A、B、C、D、E是周期表中前30号元素。已知A的最外层电子数是其内层电子数的2...
- 下列分子中的中心原子杂化轨道的类型相同的是[ ]A.CO2与SO2B.CH4与NH3C.BeCl2与BF3D.C2H2与C2H4
- 常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答(1)“氯盐类”融雪剂主要成分的晶体类型为______;(2)...
- (二选一)黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg...
- 判断以下常见分子的中心原子的杂化轨道类型(用序号填空)。① NH4+② CH2O ③ NH3④ SO2⑤ BeCl2⑥ H2O ⑦ CO2sp3杂化的是_________...
- 若某共价化合物分子中只含有C、N、H三种元素,且以n(C)、n(N)分别表示C、N的原子数目,则H原子数目最多等于[ ]A. 2n(C)+2+n(N...
- 下列有机分子中,所有的原子不可能处于同一平面的是[ ]A.CH2=CH-CNB.CH2=CH-CH=CH2C.D.CH2=C(CH3)-CH=CH2
- 鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性。已知鲨烯分子含30个C原子及6个C=C且不...
- 桶烯(Barrelene)结构简式如图所示,有关说法不正确的是[ ]A.桶烯分子中所有原子可能在同一平面内B.桶烯在一定条件下能发...
- 下列与有机物有关的说法,正确的是( ) A.聚乙烯可以使溴的四氯化碳溶液褪色 B.石油的分馏和煤的干馏都是物理变化 C.甲烷...