本试题 “下列各物质的分类、名称(或俗名)、化学式都正确的是( )A.碱性氧化物、氧化铁、FeOB.酸性氧化物、碳酸气、CO2C.酸、硫酸、H2SD.盐、纯碱、NaOH” 主要考查您对物质的简单分类
电子式的书写
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的简单分类
- 电子式的书写
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质 注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质
混合物没有固定的组成,一般没有固定的熔沸点
常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分
注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质
注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质
(1)金属单质:如Fe、Al、Cu等
(2)非金属单质:如Cl2、O2、S等
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物
①酸:电离理论认为电解质电离出阳离子全部是H+的化合物
常见的强酸:HClO4 H2SO4 HCl HNO3等
常见的弱酸:H2SO3 H3PO4 HF H2CO3 CH3COOH等
②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物
常见强碱:NaOH KOH Ba(OH)2 Ca(OH)2等
常见弱碱:NH3·H2O Al(OH)3 Fe(OH)3等
③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐
a正盐:Na2SO4 Na2CO3 (NH4)2SO4 等
b酸式盐:NaHCO3 NaHSO4 NaH2PO4 Na2HPO4等
c碱式盐:Cu(OH)2CO3 Mg(OH)2CO3等
d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等
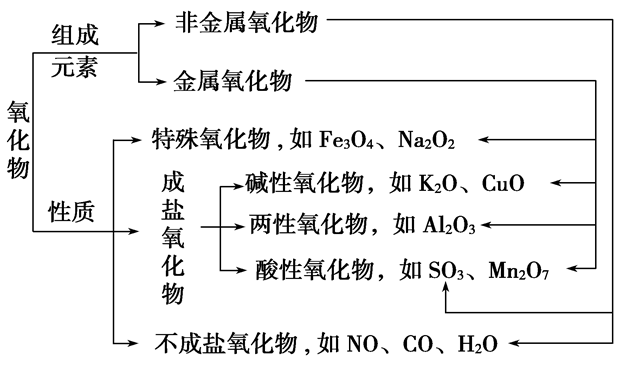
(6)氧化物:由两种元素组成,其中一种元素是氧的化合物
①按组成分:
金属氧化物:Na2O Al2O3 Fe3O4等
非金属氧化物:NO2 SO2 CO2等
②按性质分:
不成盐氧化物:CO NO等
酸性氧化物:CO2 SO2等
碱性氧化物:Na2O CuO等
两性氧化物:Al2O3 ZnO等
过氧化物:Na2O2 H2O2等
超氧化物:KO2等
特殊例子提醒:
(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
(3)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、CuO)。
(5)与水反应生成酸的氧化物不一定是酸性氧化物(如NO2);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2)。
无机物分类:

氧化物的分类:
定义:
在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“· ”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H· 、Na· 、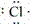
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n-”: 、
、 、
、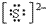
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并: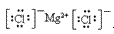 、
、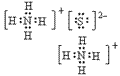
(5)共价化合物的电子式:画出离子最外层电子数: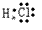 、
、
(6)用电子式表示物质形成的过程:
氯化氢的形成过程: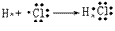
氯化镁的形成过程: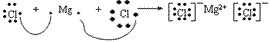
结构式:
共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如: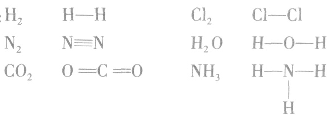
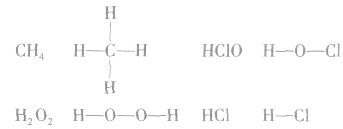
书写电子式的常见错误:
1.漏写未参与成键的电子,如: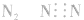
2.化合物类型不清,漏写或多写“[]”及错写电荷数,如: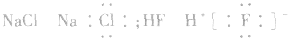
3.书写不规范,错写共用电子对如:N2的电子式为: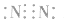 ,不能写成:
,不能写成: ,更不能写成:
,更不能写成: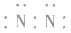 或
或 。
。
4.不考虑原子间的结合顺序如:HClO的电子式为 ,而非
,而非 。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如: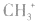 的电子式为
的电子式为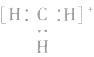 ,而非
,而非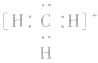 , 因
, 因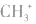 中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如: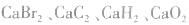 中
中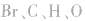 均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为:
均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为: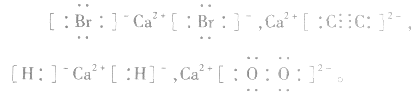
与“下列各物质的分类、名称(或俗名)、化学式都正确的是( )A...”考查相似的试题有:
- 1985年,科学家发现一种新的分子组成的物质,其化学式为C60,下列有关的说法不正确的是( )A.它的式量为720B.它是一种单质...
- 下列说法正确的是[ ]A.凡是含有氧元素的化合物都是氧化物B.电离时有酸根离子生成的化合物叫做盐C.电离时生成的阴离子全部...
- 下列有关说法正确的是[ ]A.同主族元素的原子序数可能相差16、26、36、46B.由两种不同原子组成的纯净物一定是化合物C.任何...
- 经测定一瓶气体中只含有C、H两种元素,通常情况下这瓶气体不可能是[ ]A.一种化合物B.一种单质和一种化合物的混合物C.两种...
- 经分析,某物质只含有一种元素,则此物质[ ]A.一定是一种单质B.一定是纯净物C.一定是混合物D.可能是纯净物,也可能是混合物
- 下图所示反应I、反应Ⅱ和反应Ⅲ均是工业生产中常见的反应。其中A、B为化合物,C是温室气体之一,D和 K均可用做干燥剂,常温下H...
- 下列化学用语正确的是( ) A.HF的电子式: B.乙醇的分子式:C2H6O C.磷原子的结构示意图: D.乙烯的结构式:H-C=C-H
- 下列化学用语正确的是[ ]A.钙离子的电子式 Ca2+B.甲基的电子式C.原子核内有8个中子的碳原子D.乙烷的分子式 CH3CH3
- 下列物质的俗名与其化学式、用途都相符的是( )A.烧碱、Na2CO3、制玻璃B.小苏打、NaHCO3、治疗胃酸过多C.苏打、NaOH、造...
- 下列电子式书写正确的是( ) A.NaCl: B.OH-: C.HCl: D.Na2O2: