本试题 “胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8nH2O)等化合物。(1)三硅酸镁的氧化物形式为__________ ,某元素与镁元素不同周期但在相邻一族,且性...” 主要考查您对二氧化硅
硅酸盐
能层和能级
电子排布式
元素周期律
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化硅
- 硅酸盐
- 能层和能级
- 电子排布式
- 元素周期律
二氧化硅:
①化学式SiO2
②相对分子质量:60
③类别:酸性氧化物
④晶体类型:原子晶体
⑥晶体中粒子间的作用力:共价键
二氧化硅的物理性质和化学性质:
(1)物理性质:无色透明或白色粉末,原子晶体,熔沸点都很高,坚硬难熔,不溶于水,天然的二氧化硅俗称硅石,是构成岩石的成分之一。
(2)化学性质:不活泼
①不与水反应,不能跟酸(氢氟酸除外)发生反应。
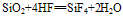 (氢氟酸不能盛放在玻璃容器中)。
(氢氟酸不能盛放在玻璃容器中)。②具有酸性氧化物的性质,能跟碱性氧化物或强碱反应。
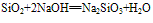 (实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
(实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
 (制玻璃)
(制玻璃)③具有弱氧化性


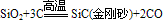
知识点拨:
二氧化硅晶体的结构若在硅晶体结构中的每个Si—Si键中“插入”一个氧原子,便可得到以硅氧四面体 (SiO4)为骨架的二氧化硅的结构,如图所示。在二氧化硅晶体里,硅原子和氧原子交替排列,不会出现Si—Si键和O—O键,即每个硅原子与四个氧原子形成四个共价键,每个氧原子与两个硅原子形成共价键,因此,二氧化硅晶体中硅原子和氧原子的个数比为1:2,二氧化硅的化学式为SiO2.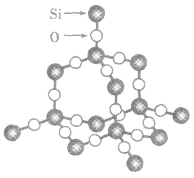
二氧化硅的用途:
①光导纤维的主要原料
②石英的主要成分是SiO2,纯净的石英可用来制造石英玻璃。石英晶体中有时含有其他元素的化合物,它们以溶解状态存在于石英中,呈各种颜色。纯净的SiO2晶体叫做水晶,它是六方柱状的透明晶体,是较贵重的宝石。 水晶常用来制造电子工业中的重要部件、光学仪器,也用来制造高级工艺品和眼镜片。
③玛瑙石含有有色杂质的石英晶体,可用于制造精密仪器轴承,耐磨器皿和装饰品。
①硅酸盐是构成地壳岩石的主要成分,其结构复杂,组成可用二氧化硅和金属氧化物的形式表示。例如:硅酸钠Na2SiO3(Na2O·SiO2);镁橄榄石Mg2SiO4(2MgO·SiO2);高岭石Al2(Si2O5)(OH)4(Al2O3·2SiO2·2H2O)
②云母、滑石、石棉、高岭石等,它们都属于天然的硅酸盐。
③人造硅酸盐:主要有玻璃、水泥、各种陶瓷、砖瓦、耐火砖、水玻璃以及某些分子筛等。
④硅酸盐制品性质稳定,熔点较高,难溶于水,有很广泛的用途。最简单硅酸盐是硅酸钠,其水溶液俗称水玻璃,是一种矿物胶,可作粘合剂,防腐剂。
硅酸钠:
(1)化学式:Na2SiO3
(2)俗称:其水溶液俗称水玻璃
(3)物理性质:硅酸钠溶液是无色黏稠液体
(4)化学性质:
①与盐酸反应 Na2SiO3+2HCl==== 2NaCl+H2SiO3(胶体)
②与CO2反应 NaSiO3+CO2+H2O ==Na2CO3+H2SiO3↓
③与水发生水解反应硅酸钠溶液显碱性
(5)制备:SiO2+2NaOH== Na2SiO3+H2O
(6)保存:试剂瓶不能配磨口玻璃塞
(7)用途:常用于制备硅胶和木材防火剂等
(1)能层:在多电子的原子核外电子的能力是不同的,按电子的能力差异,可将核外电子分成不同的能层。
能层表示两方面意义:
①表示电子到原子核的平均距离不同
②表示电子的能力不同
能层分为:K L M N O P…
所包含电子数:2 8 18 32 …
(2)能级:在多电子原子中,同一能层的电子能量也不同,还可以把它们分成能级。
能级表示两方面意义:
①表示电子云形状不同,s电子云是以原子核为中心的球形,P电子云是表示以原子核为中心的无柄哑铃型(纺锤形),d和f电子云形状更复杂
②表示能量不同,s p d f电子能量依次增高。
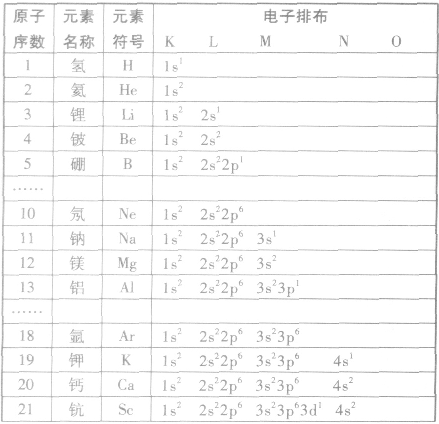
能层、能级、原子轨道及所含电子数之间的关系:
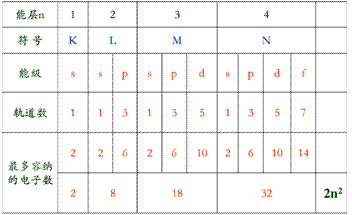
第n能层,有n个能级,有n2个原子轨道,最多容纳2n2个电子
电子排布式:
①简化电子排布式
为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的冗素符号外加方括号表示,即为简化电子排布式,如K 的简化电子排布式为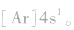
②特殊电子排布式
有个别元素的基态原子的电子排布对于构造原理有1个电子的反常。因为能量相同的原子轨道在全充满( )、半充满(
)、半充满(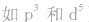 )和全空(
)和全空(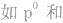
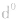 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。 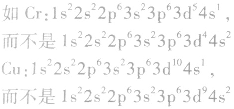
(2)电子排布图:用方框表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。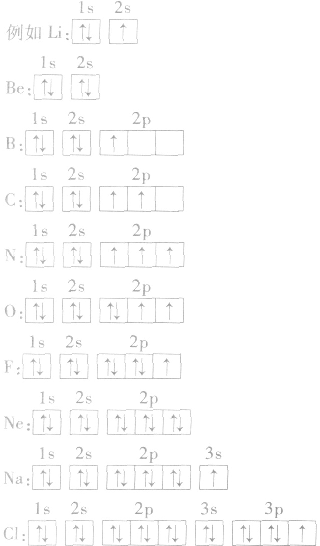
构造原理:
多电子原子的核外电子排布总是按照能量最低原理,由低能级逐步填充到高能级。绝大多数元素的原子核外电子的排布遵循下图所示的排布顺序,这种排布顺序被称为构造原理。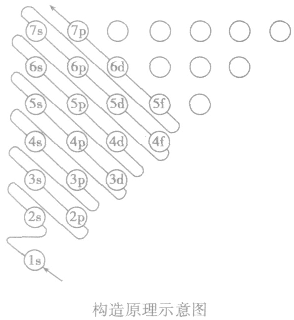
点拨:构造原理中的排布顺序,其实质是各能级的能量高低顺序,可由下列公式得出ns<(n一2)f< (n一1)d<np(n表示能层序数)。常用的重要的能级交错顺序有: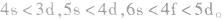
核外电子排布式一构造原理的应用:
根据构造原理,按照能级顺序,用能级符号右上角的数字表示该能级上电子数的式子,叫做电子排布式。例如,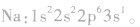
定义:
元素的性质随原子序数的递增而呈现周期性变化的规律叫元素周期律。
实质:
元素性质随原子序数递增呈现周期性变化是元素原子的核外电子排布周期性变化的必然结果。
元素周期表中主族元素性质递变规律:

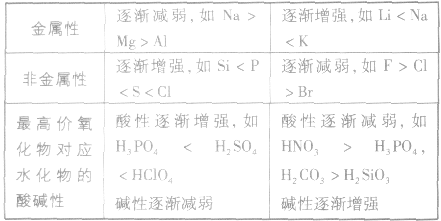
金属性强弱的判断依据:
1.单质跟水或酸反应置换出氢的难易程度(或反应的剧烈程度):反应越容易,说明其金属性越强。
2.最高价氧化物对应水化物的碱性强弱:碱性越强,说明其金属性越强,反之则越弱。
3.金属间的置换反应:依据氧化还原反应的规律,金属甲能从金属乙的盐溶液里置换出乙,说明甲的金属性比乙强。
4.金属活动性顺序按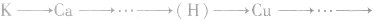 Au顺序,金属性逐渐减弱。
Au顺序,金属性逐渐减弱。
5.元素周期表中,同周期元素从左至右金属性逐渐减弱;同主族元素从上至下金属性逐渐增强。
6.原电池中的正负极:一般情况下,活泼金属作负极。
7.金属阳离子氧化性的强弱:阳离子的氧化性越强.对应金属的金属性就越弱。
非金属性强弱的判断依据:
1.同周期元素,从左到右,随核电荷数的增加,非金属性增强;同主族元素,从上到下,随着陔电荷数的增加,非金属性减弱。
2.最高价氧化物对应水化物的酸性强弱:酸性越强,其元素的非金属性也越强,反之则越弱。
3.气态氢化物的稳定性:稳定性越强,非金属性越强。
4.单质跟氢气化合的难易程度:越易与H2反应,说明其非金属性越强。
5.与盐溶液之间的置换反应:非金属元素甲的单质能从非金属乙的盐溶液中置换出乙,说明甲的非金属性比乙强。如 ,说明溴的非金属性比碘强。
,说明溴的非金属性比碘强。
6.相互化合后的价态:如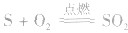 ,说明O 的非金属性强于S。
,说明O 的非金属性强于S。
7.其他:如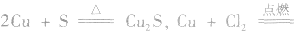 CuCl2,所以C1的非金属性强于S。
CuCl2,所以C1的非金属性强于S。
微粒半径大小的比较方法:
1.同周期元素的微粒
同周期元素的原子或最高价阳离子半径随核电荷数增大而减小(稀有气体元素除外),如半径:Na>Mg >Al,Na+>Mg2+‘>Al3+。
2.同主族元素的微粒
同主族元素的原子或离子半径随核电荷数增大而增大,如半径: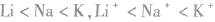
3.电子层结构相同的微粒电子层结构相同(核外电子排布相同)的微粒半径随核电荷数的增加而减小,如半径: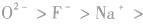
 (上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
(上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
4.同种元素形成的微粒同种元素原子形成的微粒半径大小为:阳离子< 中性原子<阴离子;价态越高的微粒半径越小,如半径: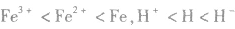 。
。
5.核外电子数和核电荷数都不同的微粒可通过一种参照物进行比较,如比较 的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子
的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子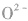 进行比较,半径:
进行比较,半径: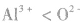 ,且
,且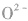
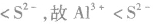
元素周期表中的几项重要规律相等规律:
| 规律 | 内容 |
| 相等规律 | ①周期数:电子层数 ②主族元素原子的最外层电子数=价电子数=主族序数=最高正化合价(F、 0除外) ③最低负价绝对值=8一主族序数(限 ⅣA族~ⅦA族非金属元素) |
| “位、构、性”规律 | |
| 递变规律 | 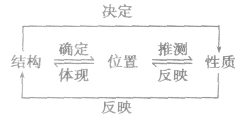 |
| 同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强同主族从上到下,元素的金属性逐渐增强,非金属性逐渐减弱 | |
| 奇偶规律 | 在同一主族内,族序数和原子序数、核内质子数、核电荷数、核外电子数、最外层电子数(价电子数)、离子的电荷数、元素的主要正负化合价数等,若一个是偶数,其他的都是偶数,若一个是奇数,其他的都是奇数 |
| 相同电子层结构的规律 | 稀有气体元素的原子与同周期非金属元素的阴离子以及下一周期主族金属元素的阳离子具有相同的电子层结构 |
| 序差规律 | ①同主族相邻元素的原子序数之差与主族序数有关。IA~ⅡA族元素相差原子序数较小的元素所在周期包含的元素种数。ⅢA族~O族元素相差原子序数较大的元素所在周期包含的元素种数。如Na和K的原子序数相差8 (第三周期含8种元素),Cl和Br的原子序数相差18(第四周期含18种元素) ②同周期主族元素(长周期)的原子序数差:两元素分布在过渡元素同侧时,原子序数差=族序数差;两元素分布在过渡元素两侧时,第四或第五周期元素原子序数差=族序数差+10(如第四周期的Ca和Ca相差11),第六、七周期元素原子序数差=族序数差+24(如ⅡA 族的Ba和ⅢA族的Tl相差25) |
| 对角线相似规律 | 周期表中位于对角线位置的元素性质相似,尤以“和Mg、Be和Al最为典型 |
与“胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8nH2O)...”考查相似的试题有:
- 【二选一—物质结构与性质】碳元素是构成有机物的基础元素。(1)写出碳元素核外电子排布式_____________。(2)甲烷与水分子...
- 黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血...
- 下列各项比较中正确的是A.共价键极性CCl4>SiCl4B.沸点CH3CH2OH>CH3CH2ClC.元素的电负性Ca>MgD.晶格能KCl>NaCl
- 今年3月11日发生在日本近海的9.0级地震使日本福岛第一核电站2号机组发生爆炸,放射性物质131 53I扩散到周围环境中引发了放射...
- (7分)下表是元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:族周期IA 01①ⅡAⅢAⅣAⅤAⅥAⅦA 2 ②③④ 3⑤⑥⑦⑧
- 从宏观方面看物质是由元素组成的,从微观方面看物质是由粒子构成的,下列有关说法不正确的是( )A.元素原子的多样性是由构...
- 根据C含量,能测出古代物品所处的年代。C中的“14”是指碳原子中的A.质子数B.中子数C.电子数D.质量数
- 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,...
- 在元素周期表的主族元素中,甲元素与乙、丙、丁三种元素上下、左右相邻,丙元素的原子序数等于甲、乙两种元素的原子序数之和...
- 下列说法中正确的是 ( )A.次外层电子数是2或8的原子一定不是副族元素B.离子化合物中不存在共价键C.质量数就是原子的相对原...