本试题 “实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的现象正确的是( )①装有铜片的孔穴中溶...” 主要考查您对(浓)硫酸
(浓、稀)硝酸
氨基酸
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- (浓)硫酸
- (浓、稀)硝酸
- 氨基酸
硫酸:
硫酸的分子式:H2SO4;结构式: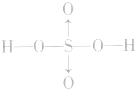 ,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
硫酸的物理性质和化学性质:
1.硫酸的物理性质
纯硫酸是无色、黏稠的油状液体,密度大,沸点高,是一种难挥发的强酸,易溶于水,能以任意比与水互溶.浓硫酸溶于水时放出大量的热。常见浓硫酸的质量分数为98.3%,其密度为 1.84g·cm-3,沸点为338℃,物质的量浓度为18.4mol·L-1.H2SO4的浓度越大,密度越大,若将30%的H2SO4溶液与10%的H2SO4溶液等体积混合,所得溶液的质量分数大于20%。
2.稀硫酸的化学性质
稀硫酸具有酸的通性。
(1)与指示剂作用:能使紫色石蕊试液变红。
(2)与碱发生中和反应
(3)与碱性氧化物或碱性气体反应 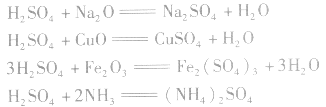
(4)与活泼金属发生置换反应 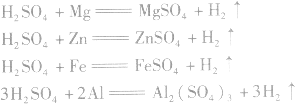
(5)与某些盐溶液反应 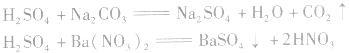
4.浓硫酸的特性
(1)吸水性将一瓶浓硫酸敞口放置在空气中,其质量将增加,密度将减小,浓度降低,体积变大。这是因为浓硫酸具有吸水性,实验室里常利用浓硫酸作干燥剂。
浓硫酸不仅可以吸收空气中的水,还可吸收混在气体中的水蒸气、混在固体中的湿存水、结晶水合物中的部分结晶水。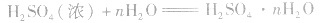 。
。
浓H2SO4中的H2SO4分子可强烈地吸收游离的水分子形成一系列的硫酸水合物: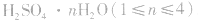 。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有
。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有 、
、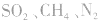 等酸性或中性气体,而具有还原性的气体
等酸性或中性气体,而具有还原性的气体 和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如
和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如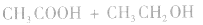
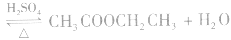 中,浓H2SO4作催化剂和吸水剂。
中,浓H2SO4作催化剂和吸水剂。
(2)脱水性指浓H2SO4将有机物里的氧、氧元素按原子个数比2:1脱去生成水的性质。浓H2SO4从有机物中脱下来的是氢、氧元素的原子,不是水,脱下来的氢、氧元素的原子按2:1的比例结合成H2O;对于分子中所含氢、氧原子个数比为2:l的有机物(如蔗糖、纤维素等),浓H2SO4可使其炭化变黑,如: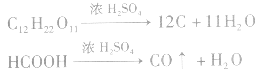
(3)强氧化性常温下,Fe、Al遇浓H2SO4会发生钝化。但热的浓 H2SO4能氧化大多数金属(除金、铂外)、某些非金属单质及一些还原性化合物。如: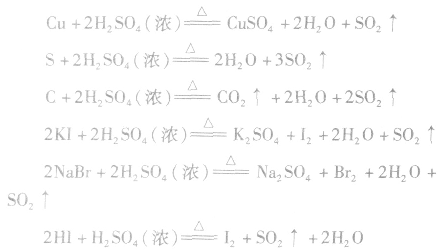
在这些氧化还原反应中,浓硫酸的还原产物一般为SO2。
浓、稀硫酸的比较与鉴别:
1.比较
稀硫酸—弱氧化性—可与活泼金属反应,生成H2—氧化性由H+体现。
浓硫酸——强氧化性——加热时可与绝大多数金属和某些非金属反应,通常生成SO2——氧化性由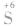 体现。
体现。
2.鉴别
从浓H2SO4和稀H2SO4性质的差异人手,可知鉴别浓H2SO4和稀H2SO4的方法有多种。
方法一:取少量蒸馏水,向其中加入少量试样硫酸,如能放出大量热则为浓H2SO4,反之则为稀H2SO4。
方法二:观察状态,浓H2SO4呈黏稠状,而稀H2SO4为黏稠度较小的溶液。
方法三:用手掂掂分量,因为浓H2SO4的密度较大 (1.84g·cm-3,相同体积的浓H2SO4和稀H2SO4,浓H2SO4的质量比稀H2SO4大很多。
方法四:取少量试样,向其中投入铁片,若产生气体,则为稀H2SO4, ;若无明显现象(钝化),则为浓H2SO4。
;若无明显现象(钝化),则为浓H2SO4。
方法五:用玻璃棒蘸取试样在纸上写字,立即变黑 (浓H2SO4的脱水性)者为浓H2SO4,另一种为稀H2SO4。
方法六:取少量试样,分别投入一小块铜片,稍加热发生反应的(有气泡产生)为浓H2SO4。(浓H2SO4的强氧化性),无现象的是稀H2SO4.
硫酸的用途及使用:
(1)用途硫酸是化学工业最黄要的产品之一,它的用途极广(如下图)。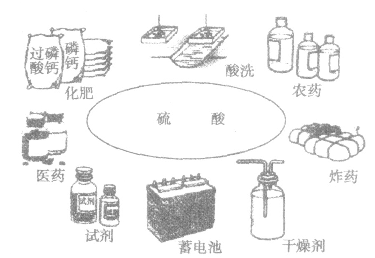
①利用其酸性可制磷肥、氮肥,可除锈,可制实用价值较高的硫酸盐等。
②利用其吸水性,在实验室浓H2SO4常用作干燥剂。
③利用其脱水性,浓H2SO4常作精炼石油的脱水剂、有机反应的脱水剂等。
④利用浓H2SO4的高沸点和难挥发性,常用于制取各种挥发性酸。
⑤浓H2SO4常作有机反应的催化剂。
(2)浓硫酸的安全使用
①浓H2SO4的稀释稀释浓硫酸时应特别注意:将浓硫酸沿器壁慢慢地注入水中,并不断搅拌,使产生的热量迅速地扩散出去。切不可把水倒人浓硫酸里。两种液体混合时,要把密度大的加到密度小的液体中,如浓H2SO4、浓HNO3-混合酸的配制方法是把浓H2SO4沿器壁慢慢地注入浓HNO3中。
②万一不小心将浓硫酸溅到皮肤上、衣服上或桌面上,应分别怎样处理?
皮肤上:用干布迅速拭去,再用大量水冲洗,最后涂上3%~5%的碳酸氢钠溶液。
衣服上:用大量水冲洗。
桌面上:大量时,用适量。NaHCO3,溶液冲洗,后用水冲洗,再用抹布擦干;少量时用抹布擦即可。
硝酸的分子结构:
化学式(分子式):HNO3,结构式:HO—NO2。 HNO3是由极性键形成的极性分子,故易溶于水,分子问以范德华力结合,固态时为分子晶体。
硝酸的物理性质和化学性质:
(1)物理性质:纯硝酸是无色油状液体, 开盖时有烟雾,挥发性酸[沸点低→易挥发→酸雾]
熔点:-42℃,沸点:83℃。密度:1.5 g/cm3,与水任意比互溶,98%的硝酸为发烟硝酸,69%以上的硝酸为浓硝酸。
(2)化学性质:
①具有酸的一些通性:例如: 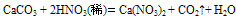 (实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)
(实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)
②不稳定性:HNO3见光或受热发生分解,HNO3越浓,越易分解.硝酸分解放出的NO2溶于其中而使硝酸呈黄色。有关反应的化学方程式为: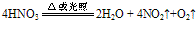
③强氧化性:不论是稀HNO3还是浓HNO3,都具有极强的氧化性,HNO3浓度越大,氧化性越强。其氧化性表现在以下几方面
A. 几乎能与所有金属(除Hg、Au外)反应。当HNO3与金属反应时,HNO3被还原的程度(即氮元素化合价降低的程度)取决于硝酸的浓度和金属单质还原性的强弱。对于同一金属单质而言,HNO3的浓度越小,HNO3被还原的程度越大,氮元素的化合价降低越多。一般反应规律为:
金属 + HNO3(浓) → 硝酸盐 + NO2↑ + H2O
金属 + HNO3(稀) → 硝酸盐 + NO↑ + H2O
较活泼的金属(如Mg、Zn等) + HNO3(极稀) → 硝酸盐 + H2O + N2O↑(或NH3等)
金属与硝酸反应的重要实例为:
①
该反应较缓慢,反应后溶液显蓝色,反应产生的无色气体遇到空气后变为红棕色(无色的NO被空气氧化为红棕色的NO2)。实验室通常用此反应制取NO气体。
②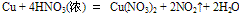
该反应较剧烈,反应过程中有红棕色气体产生。此外,随着反应的进行,硝酸的浓度渐渐变稀,反应产生的气体是NO2、NO等的混合气体。
B. 常温下,浓HNO3能将金属Fe、A1钝化,使Fe、A1的表面氧化生成一薄层致密的氧化膜。因此,可用铁或铝制容器盛放浓硝酸,但要注意密封,以防止硝酸挥发变稀后与铁、铝反应。(与浓硫酸相似)
C. 浓HNO3与浓盐酸按体积比1∶3配制而成的混合液叫王水。王水溶解金属的能力更强,能溶解金属Pt、Au。
D. 能把许多非金属单质(如C、S、P等)氧化,生成最高价含氧酸或最高价非金属氧化物。例如: 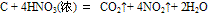
E.能氧化某些具有还原性的物质,如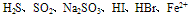 等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。
等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。
(3)保存方法:硝酸易挥发,见光或受热易分解,具有强氧化性而腐蚀橡胶,因此,实验室保存硝酸时,应将硝酸盛放在带玻璃塞的棕色试剂瓶中,并贮存在黑暗且温度较低的地方。
(4)用途:硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料、硝酸盐等。
三大强酸:
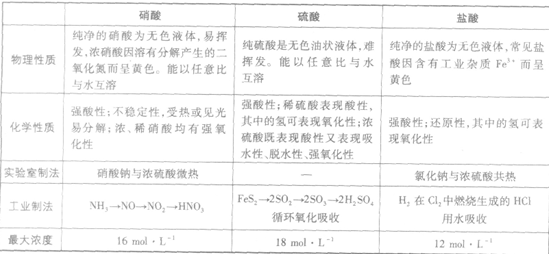
几种常见酸的比较:
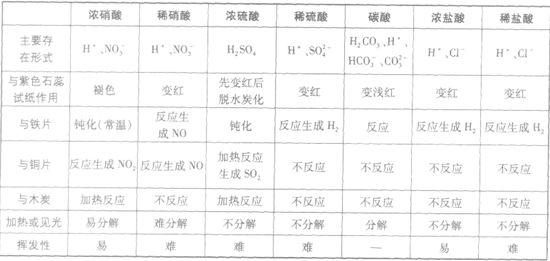
浓硝酸与稀硝酸的氧化性比较:
由铜与硝酸反应的化学方程式知,浓硝酸被还原为NO2,氮的化合价由+5→+4;而稀硝酸被还原为NO,氮的化合价由+5→+2,由此得出稀硝酸具有更强的氧化能力的结论是错误的。因为氧化剂氧化能力的强弱取决于得电子能力的强弱,而不是本身被还原的程度。实验证明,硝酸越浓,得电子的能力越强,因而其氧化能力越强。如稀硝酸能将HI氧化为I2,而浓硝酸可将HI氧化为HIO3。
硝酸在氧化还原反应中,其还原产物可能有多种价态的物质: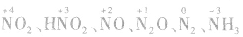 等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
浓硝酸的漂白作用:
在浓硝酸中滴入几滴紫色石蕊试液,微热,可观察到:溶液先变红后褪色,说明浓硝酸具有强氧化性,可以使某些有色物质褪色(氧化漂白)。但一般不用它作漂白剂,因为它还具有强腐蚀性。新制氯水或浓硝酸能使淀粉碘化钾试纸先变蓝后褪色,这不是因为它们的漂白性,而是因为发生了如下的化学反应: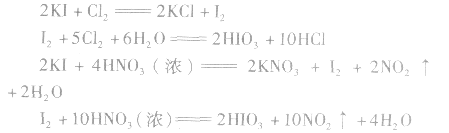
这是因为过量的氯水或硝酸又把I2氧化成了HIO3而使试纸褪色的。
另外,浓H2SO4遇湿润的蓝色石蕊试纸的现象是先变红后变黑。这是由浓H2SO4的强酸性和脱水性造成的(脱水炭化而变黑)。
氨基酸的结构:
氨基酸是羧酸分子烃基上的氢原子被氨基取代的化合物。组成蛋白质的氢基酸几乎都是α一氨基酸,其结构简式为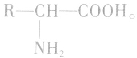
如甘氨酸(氨基乙酸):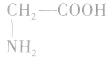
丙氨酸(α一氨基丙酸):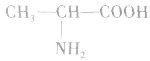
谷氨酸(2一氨基一1,5一戊二酸):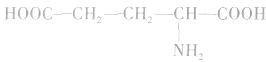
氨基酸的性质:
(1)物理性质天然的氨基酸均为无色晶体,熔点较高,在200~ 300℃熔化时分解。它们能溶于强酸或强碱溶液,除少数外一般都能溶于水,而难溶于乙醇、乙醚。
(2)化学性质
a.氨基酸的两性
氨基酸分子中一COOH是酸性基团,一NH2是碱性基因。因此,氨基酸是两性化合物,它既可以与酸反应,也可以与碱反应,且都生成盐。 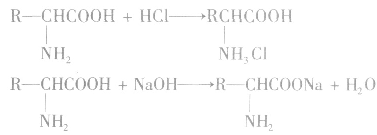
b.成肽反应
两个氨基酸分子(可以相同,也可以不同),在酸或碱的存在下加热,通过一分子的氨基与另一分子的羧基问脱去一分子水,缩合形成含有肽踺的化合物,称为成肽反应。由两个氨基酸分子脱水后形成的含有肽键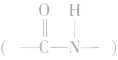 的化合物称为二肽。二肽还可以继续与其他氨基酸分子脱水生成三肽、四肽、五肽以至生成长链的多肽。
的化合物称为二肽。二肽还可以继续与其他氨基酸分子脱水生成三肽、四肽、五肽以至生成长链的多肽。
与“实验室常采用点滴板来完成部分实验,这样既可以节约药品的用...”考查相似的试题有:
- 以下物质间的转化中,其中有不能通过一步反应实现的是[ ]A.Fe - FeCl2- Fe(OH)2- Fe(OH)3B.Al - Al2O3- Al(OH)3- NaA...
- 根据CH2==CH—CH2COOH的结构,它不可能具有的性质是( )A.与新制氢氧化铜反应B.使溴的四氯化碳溶液褪色C.与乙醇在浓硫酸催化...
- (共8分)已知乳酸是酸性比碳酸强的弱酸,其结构简式为。问:⑴写出乳酸与足量金属钠反应的化学方程式__________ __ 。⑵ 写出...
- 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量...
- 牛奶放置时间长了会变酸,这是因为牛奶中含有的乳糖,在微生物的作用下分解变成了乳酸。乳酸最初就是从酸牛奶中得到并由此而...
- 化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学.(1)硅是无机非金属材料的主角.请你举出...
- 葡萄糖属于单糖的原因是( )A.在糖类物质中含碳原子数最少B.不能再水解成更简单的糖C.分子中醛基较少D.结构最简单
- 有人分析一些小而可溶的有机分子的样品,发现它们含有碳、氢、氧、氮等元素,这些样品很可能是[ ]A.脂肪酸B.氨基酸C.葡萄...
- 下列说法不正确的是( )。A.糖类物质是绿色植物光合作用的产物,是动植物所需能量的来源B.葡萄糖可用于医疗输液C.蔗糖主要存...
- 有机化合物与人类生活密不可分,生活中的一些问题常涉及化学知识。(1)有下列几种食品:①花生油中所含人体所需的主要营养物质...