本试题 “下列说法中,正确的是( )A.NO2、BF3、NC13分子中没有一个分子中原子的最外层电子都满足8电子稳定结构B.P4和CH4都是正四面体分子,两种分子中化学键之间的...” 主要考查您对键能、键长、键角
化学键与化学反应中能量变化的关系
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 键能、键长、键角
- 化学键与化学反应中能量变化的关系
共价键的键参数:
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如, 分子中:
分子中:
X原子半径: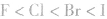
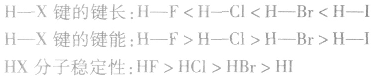
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如,
 分子中:
分子中: X原子半径:
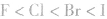
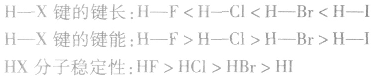
化学键与化学反应中能量变化的关系:
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若 反应为放热反应;若
反应为放热反应;若 或
或 ,反应为吸热反应。
,反应为吸热反应。
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若
 反应为放热反应;若
反应为放热反应;若 或
或 ,反应为吸热反应。
,反应为吸热反应。 发现相似题
与“下列说法中,正确的是( )A.NO2、BF3、NC13分子中没有一个...”考查相似的试题有:
- 下列有关离子键和离子化合物的说法正确的是( )A.凡含离子键的化合物,一定含金属元素B.在化合物MgCl2中,两个氯离子之间...
- 科学家发现,不管化学反应是一步完成还是分几步完成,该反应的热效应是相同的,已知在25℃、105Pa时,1molC(石墨)完全燃烧生成C...
- 下列有关说法正确的是( )A.根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键B.分子晶体的堆积均为分子密堆积C.NCl3分...
- 下列各物质中,化学键类型相同的是( )A.CO2和H2OB.F2和NaOHC.NaCl和H2SD.CCl4和KCl
- 下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ): 根据上述数据回答(1)~(6)题。(1)下列物质本身具有的能量最低的是(...
- (1)下列五种物质中①Ne ②H2O ③NH3④KOH ⑤Na2O,只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存...
- 下列物质中①Ar ②CO2③SiO2④NaOH ⑤K2S,只存在共价键的是______;只存在离子键的是______;既存在共价键又存在离子键的是______...
- 下列说法正确的是( )①离子化合物一定含离子键,也可能含极性键或非极性键②同位素的性质几乎完全相同③含金属元素的化合物不一...
- 在一密闭容器中有如下反应:L (s) + a G (g) b R (g) 温度和压强对该反应的影响如图所示,其中压强P1< P2,由此可判断A.正反...
- 下列与化学键有关的说法中正确的是A.由活泼金属元素和活泼非金属元素形成的化合物不可能含共价键B.不同种元素的原子形成的...