本试题 “A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系(图中反应条件略去) 填写下列空白.(1)若A为金属单质,B为磁性的黑色固体,写出反应...” 主要考查您对无机推断
氧化亚铁
氧化铁
四氧化三铁
氢氧化亚铁
氢氧化铁
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 无机推断
- 氧化亚铁
- 氧化铁
- 四氧化三铁
- 氢氧化亚铁
- 氢氧化铁
无机推断的解题题眼:
1.题眼一:
常见气体单质气体:H2、O2、N2、Cl2(黄绿色)、F2(淡黄绿色)
气态氢化物:NH3(无色有刺激性气味,易液化,极易溶于水,能使湿润的红色石蕊试纸变蓝,遇到HCl形成白烟)
HCl(无色有刺激性气味,极易溶于水,能使湿润的蓝色石蕊试纸变红,在空气中形成白雾,遇到NH3形成白烟)
H2S(无色有臭鸡蛋气味,蛋白质腐败的产物,能溶于水,能使湿润的醋酸铅试纸变黑)
非金属气态氧化物:CO、CO2(直线型非极性分子)、NO(遇到空气变红棕色)、NO2(红棕色,加压、降温会转变成无色N2O4)、SO2(无色、有刺激性气味、能使品红溶液褪色) [固态氧化物]:SO3(无色晶体、易挥发)、P2O5(白色固体、易吸湿,常用作干燥剂)、SiO2(不溶于水、不溶于普通酸的高熔点固体,但溶于氢氟酸和强碱溶液)
气态卤代烃:一氯甲烷(CH3Cl)、氯乙烯(CH2=CHCl)气态醛:甲醛(HCHO)
2.题眼二:
气体溶解性归纳难溶于水的:H2、N2、CO、NO、CH4、C2H4;
微溶于水的:O2、C2H2;
能溶于水的:Cl2(1:1)、H2S(1:2.6)、SO2(1:40);
极易溶于水的:NH3(1:700)、HCl(1:500)、HF、HBr、HI。
3.题眼三:
常见液态物质无机物:液溴Br2、水(H2O)、过氧化氢(H2O2)、二硫化碳(CS2)、三氯化磷(PCl3)
有机物:一般5个碳原子以上的低级烃;除一氯甲烷、氯乙烯之外的低级卤代烃;低级醇;除甲醛之外的低级醛;低级羧酸;低级酯。
4.题眼四:
常见物质的颜色
①红色:Fe(SCN)3(红色溶液); Cu2O(红色固体);Fe2O3(红棕色固体); 液溴(深红棕色);Fe(OH)3(红褐色固体);Cu(紫红色固体);溴蒸气、NO2(红棕色)
②紫色:Fe3+与苯酚反应产物(紫色);I2(有金属光泽紫黑色固体)KMnO4固体(紫黑色);MnO4-(紫红色溶液) 钾的焰色反应(紫色) I2蒸气、I2在非极性溶剂中(紫色)
③橙色:溴水(橙色) K2Cr2O7溶液(橙色)
④黄色:AgI(黄色固体);AgBr(淡黄色固体); FeS2(黄色固体);Na2O2(淡黄色固体);S(黄色固体);I2的水溶液(黄色);Na的焰色反应(黄色);工业浓盐酸(黄色)(含有Fe3+);Fe3+的水溶液(黄色);久置的浓硝酸(黄色)(溶有分解生成的NO2);浓硝酸粘到皮肤上(天然蛋白质)(显黄色);
⑤绿色:Cu2(OH)2CO3(绿色固体);Fe2+的水溶液(浅绿色);FeSO4?7H2O(绿矾);Cl2、氯水(黄绿色);F2(淡黄绿色); CuCl2的浓溶液(蓝绿色);
⑥棕色:FeCl3固体(棕黄色);CuCl2固体(棕色)
⑦蓝色:Cu(OH)2、CuSO4?5H2O、Cu2+在水溶液中(蓝色);淀粉遇I2变蓝色; Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色);
⑧黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS; AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
⑨白色:常见白色固体物质如下(呈白色或无色的固体、晶体很多):AgCl;Ag2CO3;Ag2SO4;Ag2SO3;BaSO4;BaSO3;BaCO3;CaCO3;MgO;Mg(OH)2;MgCO3;Fe(OH)2;AgOH;PCl5;SO3;三溴苯酚;铵盐(白色固体或无色晶体); Fe(OH)2沉淀在空气中的现象:白色→(迅速)灰绿色→(最终)红褐色
5.题眼五:
根据框图中同一元素化合价的变化为主线,即A→B→C→……型归纳
C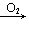 CO
CO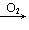 CO2;H2S
CO2;H2S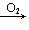 S
S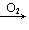 SO2
SO2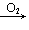 SO3(H2SO4); NH3(N2)
SO3(H2SO4); NH3(N2) NO
NO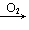 NO2→HNO3; Na
NO2→HNO3; Na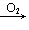 Na2O
Na2O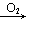 Na2O2; Fe→Fe2+→Fe(OH)2
Na2O2; Fe→Fe2+→Fe(OH)2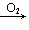 Fe(OH)3;Fe→Fe2+→Fe3+;
Fe(OH)3;Fe→Fe2+→Fe3+;
CH2=CH2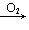 CH3CHO
CH3CHO CH3COOH;CH3CH2OH
CH3COOH;CH3CH2OH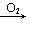 CH3CHO
CH3CHO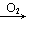 CH3COOH
CH3COOH
6.题眼六:
根据化学反应形式
(1)根据置换反应“单质+化合物=新的单质+新的化合物” 进行推理
㈠金属置换金属
铝热反应:需高温条件才能引发反应的发生,通常用来冶炼一些高熔点金属。如:2Al+Fe2O3 Al2O3+2Fe; 8Al+3Fe3O4
Al2O3+2Fe; 8Al+3Fe3O4 4Al2O3+9Fe
4Al2O3+9Fe
㈡.金属置换非金属
①金属与水反应置换出H2 2Na+2H2O==2Na++2OH-+H2↑ (非常活泼的金属在常温下与H2O反应) 3Fe+4H2O Fe3O4+4H2↑
Fe3O4+4H2↑
②金属与非氧化性酸(或氧化物)反应 2Al+6H+==2Al3++3H2↑;2Mg+CO2 2MgO+C
2MgO+C
㈢.非金属置换非金属
①非金属单质作氧化剂的如:2F2+2H2O==4HF+O2;2FeBr2+3Cl2==2FeCl3+2Br2;X2+H2S==2H++2X-+S↓(X2=Cl2、Br2、I2);2H2S+O2(不足) 2S+2H2O (H2S在空气中不完全燃烧) 2H2S+O2==2S↓+2H2O(氢硫酸久置于空气中变质)
2S+2H2O (H2S在空气中不完全燃烧) 2H2S+O2==2S↓+2H2O(氢硫酸久置于空气中变质)
②非金属单质作还原剂的如:C+H2O CO+H2 (工业上生产水煤气的反应) Si+4HF==SiF4(易挥发)+2H2↑
CO+H2 (工业上生产水煤气的反应) Si+4HF==SiF4(易挥发)+2H2↑
㈣.非金属置换金属
如:2CuO+C 2Cu+CO2↑
2Cu+CO2↑
①根据反应“化合物+化合物=单质+化合物”进行推理,常见的该类型反应有:
2Na2O2+2H2O==4NaOH+O2↑
2Na2O2+2CO2==2Na2CO3+O2
2H2S+SO2==3S↓+2H2O
KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②根据反应“一种物质三种物质”进行推理,常见该类型的反应有:
Cu2(OH)2CO3 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
2KMnO4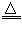 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
NH4HCO3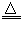 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
(NH4)2CO3 2NH3↑+CO2↑+H2O
2NH3↑+CO2↑+H2O
NH4HSO3 NH3↑+SO2↑+H2O
NH3↑+SO2↑+H2O
③根据反应“化合物+单质==化合物+化合物+……”,常见该类型的反应有:
Na2SO3+Cl2+H2O==Na2SO4+2HCl
Na2SO3+Br2+H2O==Na2SO4+2HBr
C+4HNO3(浓)==CO2↑+4NO2↑+2H2O
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
7.题眼七:
根据常见反应的特征现象。
(1)两种物质反应既有沉淀又有气体生成的
①双水解:主要指Al3+、Fe3+与CO32-、HCO3-等之间的双水解
②Ba(OH)2和(NH4)2SO4生成氨气和硫酸钡沉淀
(2)遇水能放出气体的
①Li、Na、K、Ca、Ba、Mg(△)、Fe(高温)[氢后面的金属不跟水反应]
②Na2O2、NaH、CaC2、Al2S3、Mg3N2
③加碱能产生气体的:Al、Si、NH4+
④加酸有沉淀生成的:如SiO32-、AlO2-、S2O32-、C6H5O-(常温下)
⑤有“电解”条件的,通常联想到下列代表物:
a.电解电解质型:不活泼金属的无氧酸盐如CuCl2(aq)
b.放氧生酸型:不活泼金属的含氧酸盐如CuSO4(aq)
c.放氢生碱型:活泼金属的无氧酸盐如NaCl(aq)
d.电解熔融离子化合物:如Al2O3(l)、NaCl(l)
无机推断题的突破方法:
解决无机框图推断题的一般流程是:
整体浏览、寻找突破;
由点到面、广泛联系;
大胆假设、验证确认;
明确要求、规范解答 。
解题的关键是仔细审题,依据物质的特征来寻找突破口,顺藤摸瓜,进而完成全部未知物的推断。常用的突破方法主要有以下几种。
1.依据元素或物质的特征数据突破
常用的有:
(1)在地壳中含量最多的元素是氧;
(2)在地壳中含量最多的金属元素是铝;
(3)组成化合物种类最多的元素是碳;
(4)相对分子质量最小的单质是氢气;
(5)日常生活中应用最广泛的金属是铁。
2.依据物质的特性突破
常用的有:
(1)使淀粉变蓝的是I2;
(2)能使铁、铝钝化的是冷的浓硫酸或浓硝酸;
(3)能与SiO2反应而能雕刻玻璃的是氢氟酸;
(4)能使品红溶液褪色,褪色后的溶液受热后恢复红色的是二氧化硫;
(5)遇SCN-溶液变红色的是Fe3+;
(6)在放电的条件下与氧气化合生成NO的是氮气;
(7)能与水剧烈反应生成氧气的气体是F2;
(8)具有磁性的黑色固体是Fe3O4;
(9)红棕色粉末是Fe2O3;
(10)黄绿色气体是Cl2,红褐色沉淀是Fe(OH)3,能与水反应放出气体的淡黄色粉末是Na2O2。
3.依据物质的特殊用途突破
常用的有:
(1)可作呼吸面具和潜水艇中的供氧剂的是Na2O2;
(2)可用于杀菌、消毒、漂白的物质主要有Cl2、ClO2、NaClO和漂白粉等;
(3)可用作半导体材料、太阳能电池的是晶体硅;
(4)用于制造光导纤维的是SiO2;
(5)可用于治疗胃酸过多的物质是NaHCO3、Al(OH)3等;
(6)可用于制造发酵粉的是NaHCO3;
(7)可用作钡餐的是BaSO4;
(8)可用于焊接钢轨、冶炼难熔金属的是铝热剂;
(9)可用作感光材料的是AgBr;
(10)可用作腐蚀印刷电路板的是FeCl3溶液。
4.依据特殊现象突破
常用的有:
(1)燃烧时产生苍白色火焰的是氢气在氯气中燃烧;
(2)灼烧时火焰呈黄色的是含钠元素的物质;
(3)灼烧时火焰呈紫色(透过蓝色钴玻璃)的是含钾元素的物质;
(4)在空气中迅速由无色变红棕色的气体是NO;
(5)白色沉淀迅速变为灰绿色,最后变为红褐色的是Fe(OH)2转化为Fe(OH)3;
(6)能使湿润的红色石蕊试纸变蓝色的气体是NH3;
(7)使澄清石灰水先变浑浊后变澄清的是CO2、SO2;
(8)加入NaOH溶液先产生白色沉淀后沉淀溶解的溶液中含有Al3+。
5.根据限定条件和解题经验突破
常用的有:
(1)“常见金属”往往是铁或铝;
(2)“常见气体单质”往往是H2、N2、O2、Cl2;
(3)“常用的溶剂”往往是H2O;
(4)“常温常压下为液态”的往往是H2O;
(5)“能与过量HNO3反应”则意味着某元素有变价;
(6)“与浓酸反应”的物质往往是铜、碳、MnO2等;
(7)“电解”生成三种物质的往往为NaCl溶液或CuSO4溶液或AgNO3溶液;“电解”生成两种物质的往往是电解水型的溶液,生成的两种物质为氢气和氧气。熔融电解往往是电解Al2O3、NaCl或MgCl2。
无机物间的特殊转化关系:


二、三角型转化
1.铁三角: 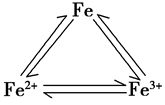
2.铝三角: 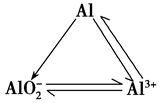
3.氯三角: 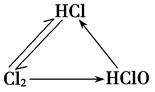
4.硅三角: 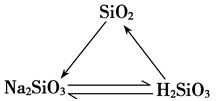
三、交叉型转化关系
1.硫及其重要化合物间的转化 :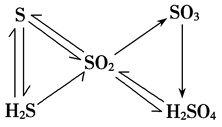
2.氮及其重要化合物间的转化 :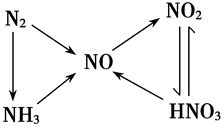
3.钠及其重要化合物间的转化 :



氧化亚铁:
(1)色态:黑色粉末
(2)溶解性:不溶于水,不与水反应,溶于盐酸、稀硫酸生成亚铁盐。
(3)稳定性:不稳定,在空气中加热时迅速被氧化成四氧化三铁
(4)氧化性:(高温下)被CO、H2、Al、C、Si等还原
(5)还原性:在空气中加热氧化为Fe3O4
氧化亚铁:
(1)色态:黑色粉末
(2)溶解性:不溶于水,不与水反应,溶于盐酸、稀硫酸生成亚铁盐。
(3)稳定性:不稳定,在空气中加热时迅速被氧化成四氧化三铁
(4)氧化性:(高温下)被CO、H2、Al、C、Si等还原
(5)还原性:在空气中加热氧化为Fe3O4
铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
氧化亚铁的化学性质:
- 铝热反应:2Al+3FeO=(高温)=Al2O3+3Fe
- 与非氧化性酸反应:FeO+2H+==Fe2++H2O
- 与氧化性酸反应:3FeO+10H++NO3-==3Fe3++NO↑+5H2O
氧化铁:
化学式Fe2O3,溶于盐酸,为红棕色粉末。其红棕色粉末为一种低级颜料,工业上称氧化铁红,用于油漆、油墨、橡胶等工业中,可做催化剂,玻璃、宝石、金属的抛光剂,可用作炼铁原料。
(1)色态:红色粉末,俗称铁锈(铁红)
(2)溶解性:溶于盐酸、稀硫酸生成+3价铁盐;难溶于水,不与水反应。
(3)氧化性:高温下被CO、H2、Al、C、Si等还原
氧化铁的化学性质:
- 铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe
- 与强酸反应:Fe2O3+6H+==2Fe3++3H2O
- 与还原性酸(HI)反应:Fe2O3+6H++2I-==2Fe2++3H2O+I2
铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
四氧化三铁:
又称磁性氧化铁,具有磁性的黑色晶体,不溶于水,具有优良的导电性。
四氧化三铁的性质:
(1)色态:具有磁性的黑色晶体
(2)别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石、偏铁酸亚铁
(3)矿物:磁铁矿
(4)溶解性:不溶于水,与酸反应生成+2、+3铁盐
(5)稳定性:稳定
(6)还原性:在高温下,易氧化成三氧化二铁。4Fe3O4+O2 6Fe2O3
6Fe2O3
(7)氧化性:在高温下可与还原剂H2、CO、Al、C等反应。 


铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
氢氧化亚铁:
化学式为Fe(OH)2,白色固体,难溶于水,碱性较弱,可与常见酸反应;在空气中易被氧化,白色→灰绿色→红褐色。反应方程式如下:
(1)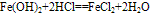
(2)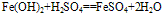
(3)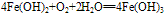
氢氧化亚铁的性质:
氢氧化亚铁极易被氧化,水中的溶解氧就可以把它氧化。
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2=△=2Fe2O3+4H2O
铁的氢氧化物:
| Fe(OH)2 | Fe(OH)3 | |
| 色态 | 白色固体 | 红褐色固体 |
| 与盐酸反应 | Fe(OH)2+2H+==Fe2++2H2O | Fe(OH)3+3H+==Fe3++3H2O |
| 热稳定性 | 在空气中加热迅速生成Fe3O4 | 2Fe(OH)3=(加热)=Fe2O3+3H2O |
| 二者的关系 | 在空气中Fe(OH)2能够非常迅速地被氧化成Fe(OH)3,现象是:白色迅速变成灰绿色,最后变成红褐色。反应方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3 | |
氢氧化亚铁的制备:
因Fe(OH)2在空气中易被氧化,4Fe(OH)2+O2+2H2O===4Fe(OH)3,故Fe(OH)2在水中不能稳定存在,在实验室制取Fe(OH)2时,一定要用新制的亚铁盐和先加热驱赶掉O2的NaOH溶液,且滴管末端要插入试管内的液面以下,再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以减少Fe(OH)2与O2的接触。关于Fe(OH)2制备的方法很多,核心问题有两点,一是溶液中溶解的氧必须除去,二是反应过程必须与O2隔绝。
1、操作方法:在试管里注入少量新制备的硫酸亚铁溶液,再向其中滴入几滴煤油,用胶头滴管吸取氢氧化钠溶液,将滴管尖端插入试管里溶液液面下,逐滴滴入氢氧化钠溶液,观察现象。另外,为使氢氧化亚铁的制备成功,先将硫酸亚铁溶液加热,除去溶解的氧气。
实验现象:滴入溶液到硫酸亚铁溶液中有白色絮状沉淀生成。白色沉淀放置一段时间,振荡后迅速变成灰绿色,最后变成红褐色。
注:白色沉淀:Fe(OH)2;灰绿色沉淀:Fe(OH)2和Fe(OH)3的混合物;红褐色沉淀:Fe(OH)3
方法的改进:可在液面上滴加苯或者油进行液封,可有效防止氧的溶解。
【典例】 Ⅰ.用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是__________________________________________________________ ________________________________________________________
Ⅱ.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。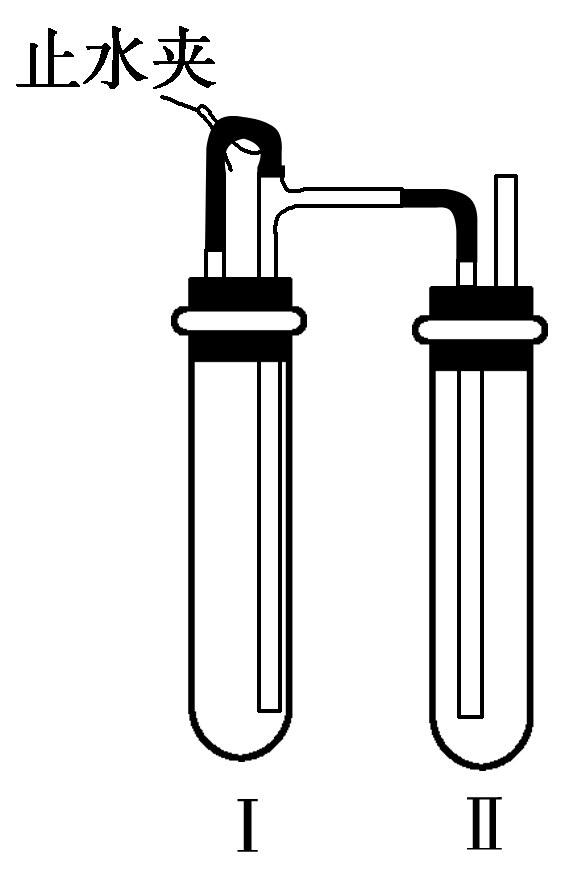
(1)在试管Ⅰ中加入的试剂是________。
(2)在试管Ⅱ中加入的试剂是________。
(3)为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_____________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,理由是_________________________________________________________________。
【答案】:Ⅰ.(1)稀H2SO4、铁屑 (2)煮沸 (3)避免生成的Fe(OH)2沉淀接触O2而被氧化 Ⅱ.(1)稀H2SO4和铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹 (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,故外界O2不易进入
2、电化学制备
【典例】 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所法实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
①a电极材料为_______,其电极反应式为_______________。
②电解液d可以是_______,则白色沉淀在电极上生成;也可以是_______,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
③液体c为苯,其作用是______________,在加入苯之前,对d溶液进行加热处理的目的是___________。
④为了在短时间内看到白色沉淀,可以采取的措施是____________________。
A.改用稀硫酸做电解液 B.适当增大电源电压 C.适当缩小两电极间距离 D.适当降低电解液温度
⑤若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为___________。
【答案】:①Fe;Fe-2e-=Fe2+ ②C;B ③隔绝空气防止Fe(OH)2被空气氧化;排尽溶液中的氧气,防止生成的Fe(OH)2在溶液中氧化 ④B、C ⑤白色沉淀迅速变成灰绿色,最后变成红褐色
氢氧化铁:
红褐色固体,难溶于水,易与酸反应;加热可分解生成氧化铁。反应方程式如下:
(1)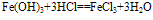
(2)
(3)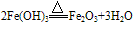
氢氧化铁胶体的制备:
操作步骤:将烧杯中的蒸馏水加热至沸腾,向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至呈红褐色为止。
离子方程式:Fe3++3H2O=(加热)=Fe(OH)3(胶体)+3H+
铁的氢氧化物:
| Fe(OH)2 | Fe(OH)3 | |
| 色态 | 白色固体 | 红褐色固体 |
| 与盐酸反应 | Fe(OH)2+2H+==Fe2++2H2O | Fe(OH)3+3H+==Fe3++3H2O |
| 热稳定性 | 在空气中加热迅速生成Fe3O4 | 2Fe(OH)3=(加热)=Fe2O3+3H2O |
| 二者的关系 | 在空气中Fe(OH)2能够非常迅速地被氧化成Fe(OH)3,现象是:白色迅速变成灰绿色,最后变成红褐色。反应方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3 | |
与“A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示...”考查相似的试题有:
- A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。请回答下列问题:(1)若X是强氧化性...
- 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.根据图示...
- 有关物质A~H的转化关系如图所示:回答下列问题:(1)写出下列物质的化学式:E______;F______;沉淀G______.(2)A→B的离...
- 某些物质的转化关系如下图所示(不是所有的产物都标出)。已知:① 若用两根玻璃棒分别蘸取A的浓溶液和浓盐酸并使它们接近时,...
- 下列反应的产物中,一定不含有+ 2价铁元素的是A.铁与盐酸B.铁与氯气C.铁与氯化铁溶液D.铁与稀硝酸
- (10分)实验室可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁的含量的实验(假设杂质不参与反应)。请回答下列...
- 某化学兴趣小组对废铁屑做如图所示的处理。相关分析正确的是:A.滤液的溶质是Fe(NO3)2B.该实验中发生的反应都为氧化还原反...
- 在下列物质转化关系中,反应的条件和部分产物已略去.回答下列问题:(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应...
- 按要求写出下列反应的化学方程式:(1)钢铁工业是国家工业的基础.请写出由CO还原赤铁矿的化学方程式:______.(2)在一定...
- (1)现有含Fe2O380%的赤铁矿100t,理论上可冶炼含Fe95%的生铁多少吨?(2)准确称取6g铝土矿(含Fe2O3、Al2O3)样品,放入盛...