本试题 “如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是:[ ]A.根据质量守恒定律可推知,1个Z分子中含有2个同种元素的原子B.该反应属于分解反应...” 主要考查您对氧化还原反应的定义
分解反应
电解质、非电解质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的定义
- 分解反应
- 电解质、非电解质
氧化还原反应:
有电子转移(得失或偏移)的反应;(无电子转移(得失或偏移)的反应为非氧化还原反应)
反应历程:
氧化还原反应前后,元素的氧化数发生变化。根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应;氧化数降低的反应,称为还原反应。氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。
氧化还原反应中存在以下一般规律:
强弱律:氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态。
优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
氧化还原性的强弱判定:
物质的氧化性是指物质得电子的能力,还原性是指物质失电子的能力。物质氧化性、还原性的强弱取决于物质得失电子的能力(与得失电子的数量无关)。从方程式与元素性质的角度,氧化性与还原性的有无与强弱可用以下几点判定:
(1)从元素所处的价态考虑,可初步分析物质所具备的性质(无法分析其强弱)。最高价态——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低价态,只有还原性,如Cl-、S2-等;中间价态——既有氧化性又有还原性,如Fe、S、SO2等。
(2)根据氧化还原的方向判断:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(3)根据反应条件判断:当不同的氧化剂与同一种还原剂反应时,如氧化产物中元素的价态相同,可根据反应条件的高、低进行判断,如是否需要加热,是否需要酸性条件,浓度大小等等。
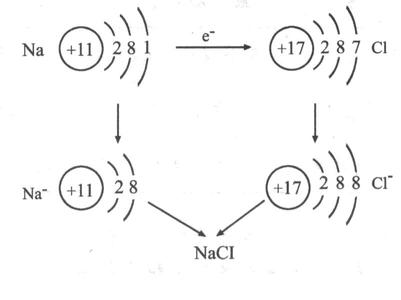
电子的得失过程:

其过程用核外电子排布变化情况可表示为:
分解反应:
一种化合物在特定条件下(如加热、通直流电、催化剂等)分解成两种或两种以上较简单的单质或化合物的反应
分解反应类型:
氧化物分解: 2H2O=(通电)2H2↑+O2↑ 2H2O2=(MnO2)2H2O+O2↑
含氧酸分解: H2CO3=(△)H2O+CO2↑ H2SO3=(△)H2O+SO2↑
碱的分解: Mg(OH)2=(高温)MgO+H2O Cu(OH)2=(△)CuO+H2O 2Fe(OH)3=(高温)Fe2O3+3H2O
2Al(OH)3=(高温)Al2O3+3H2O (注:不溶性碱高温时可分解为金属氧化物和水)
盐的分解: 2NaHCO3=(△)Na2CO3+CO2↑+H2O Ca(HCO3)2=(△)CaCO3+CO2↑+H2O CaCO3=(高温)CaO+CO2↑
2KMnO4=(△)K2MnO4+MnO2+O2↑ 2KClO3=(△,MnO2)2KCl+3O2↑
分解反应的模型:
A=B+C 可以简单理解为“一变多”,也可以理解成为由一种反应物发生化学反应后生成两种或两种以上的物质的反应。
分解反应与氧化还原反应的关系:
分解反应不一定是氧化还原反应,例如:2Al(OH)3=(高温)Al2O3+3H2O
只有能产生单质的分解反应才是氧化还原反应,例如:2H2O=(通电)2H2↑+O2↑
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
与“如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不...”考查相似的试题有:
- 下列化学应用中不涉及氧化还原反应的是[ ]A.FeCl3用于溶解线路板上的铜B.碳酸氢纳用于治疗胃酸过多C.铝热反应用于冶炼高熔...
- 下列反应中,既属于氧化还原反应又属于置换反应的是( )A.CuO+H2 △ . Cu+H2OB.CO2+Ca(OH)2=CaCO3↓+H2OC.Fe2O3+3CO △ . ...
- 氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3,NaH+H2O→NaOH+H2↑.有关Na3N和NaH的叙述正确的是( )A.离...
- 回答下列有关氧化还原反应的问题:(1)在下列反应中:A.2F2+2H2O=4HF+O2↑;B.2Na+2H2O=2NaOH+H2↑;C.CaO+H2O=Ca(OH)2;...
- 自然界中存在的元素大多以化合态存在,若要把某元素由化合态变为游离态,则它( )A.被氧化B.被还原C.有可能被氧化,也有...
- 对于有反应3Cl2+6KOH(浓、热)═5KCl+KClO3+3H2O,以下叙述正确的是( )A.KClO3是还原产物,具有还原性B.氧化剂与还原剂物...
- 下列有关实验事实的解释中正确的是[ ]问题解释A.实验室不能配制含有Fe3+、MnO4-、SO42-、Ba2+的中性溶液Fe3+水解呈酸性B.含有...
- 下列状态的物质,既能导电又属于电解质的是A.MgCl2晶体B.熔融的NaClC.液态酒精D.KOH溶液
- 下列物质中,属于电解质的是( )A.稀盐酸B.Cu丝C.NaClD.蔗糖
- 下列状态的物质,既能导电又属于电解质的是( )A.MgCl2晶体B.NaCl溶液C.液态HClD.熔融的KOH