本试题 “某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-H++B2-。回答下列问题。(1)Na2B溶液显________(填“酸性”、“中性”或“碱性”),...” 主要考查您对弱电解质电离的影响因素
弱电解质的电离度
弱电解质的电离
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质电离的影响因素
- 弱电解质的电离度
- 弱电解质的电离
电离平衡的影响因素:
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:
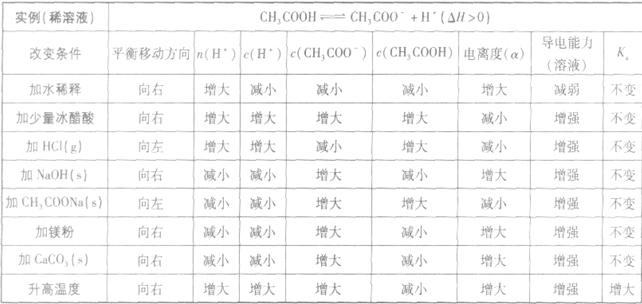
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:

电离度:
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
发现相似题
与“某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++H...”考查相似的试题有:
- 常温下,将0.05 mol·L-1盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液12.5 mL和pH=3...
- 已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是[ ]A.加...
- 下列各选项所述的两个量中,前者一定小于后者的是( )A.纯水在25 ℃和100 ℃时的pHB.CH3COONa溶液中Na+和CH3COO-的浓度C....
- 下列含氧酸中,酸性最弱的是( )A.HClOB.HNO2C.H2SO4D.HIO4
- (16分)NH3在生活生产中用途广泛。(1)下列关于NH3或氨水的实验能达到目的的是 (填编号)编号ABCD 实验装置实验目的实验室...
- pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液的pH仍相同,则m和n的关系是[ ]A. m = nB. m> n...
- (1)0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象是________,其主要原...
- 相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意...
- (10分)25℃时,50mL0.1mol/L醋酸中存在下述平衡: 若分别作如下改变,对上述平衡有何影响?⑴加入少量冰醋酸,平衡将 ,溶液...
- (1)常温下,0.05mol/L硫酸溶液中,c(H+)=____________mol/L,pH值为___________,水电离的c(H+)=___________ mol/L(2)某...