本试题 “Li-SOCl2电池可用于心脏起博器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2。请回答下列问...” 主要考查您对氢氧化钠
其他钠盐(氯化钠、硫化钠、氮化钠等)
原电池电极反应式的书写
一次电池
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氢氧化钠
- 其他钠盐(氯化钠、硫化钠、氮化钠等)
- 原电池电极反应式的书写
- 一次电池
氢氧化钠:
俗称火碱、烧碱、苛性钠
(1)与酸反应:NaOH+HCl==NaCl+H2O、2NaOH+H2SO4==Na2SO4+2H2O
(2)与非金属氧化物反应:2NaOH+CO2==Na2CO3+H2O、2NaOH+SO2==Na2SO3+H2O 、2NaOH+SO3==Na2SO4+H2O、2NaOH+SiO2==Na2SiO3+H2O
(3)与盐反应:2NaOH+CuCl2==Cu(OH)2+2NaCl
氢氧化钠的物理性质:
氢氧化钠为白色半透明,结晶状固体。其水溶液有涩味和滑腻感。密度:2.130g/cm3,熔点:318.4℃,沸点:1390℃。
溶解性:极易溶于水,溶解时放出大量的热。易溶于水醇、乙醇以及甘油。(氢氧化钠具有潮解性)
吸湿性:固碱吸湿性很强,露放在空气中,最后会完全溶解成溶液。
氢氧化钠的化学性质:
强碱性:
氢氧化钠溶液是常见的强碱,具有碱的通性:
①使酸碱指示剂变色:能使石蕊溶液变蓝,能使酚酞溶液变红;
②与酸发生中和反应生成盐和水;NaOH+HCl=NaCl+H2O
③与某些盐反应生成新盐和新碱;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
④与酸性氧化物反应生成盐和水。2NaOH+CO2====Na2CO3+H2O
腐蚀性:
氢氧化钠对玻璃制品有轻微的腐蚀性,两者会生成硅酸钠,使得玻璃仪器中的活塞黏着于仪器上。如果以玻璃容器长时间盛装热的氢氧化钠溶液,会造成玻璃容器损坏。
氢氧化钠溶液与CO2的反应规律:
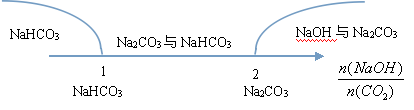
当二氧化碳少量时:2NaOH+CO2(少量)=Na2CO3+H2O
当二氧化碳过量时:Na2CO3+CO2(过量)+H2O=2NaHCO3
当二氧化碳与氢氧化钠的物质的量之比大于1小于2时,生成碳酸钠与碳酸氢钠的混合物。具体各产物的物质的量可根据钠元素守恒和碳元素守恒求算。
其他的常见钠盐:
(1)氯化钠:与硝酸银反应:Cl-+Ag+==AgCl↓
工业上--制碱、生活中--食用、医用上--生理盐水氯化钠(NaCl)
用途:可用于食品调味和腌鱼肉蔬菜;制造氯气、氢气、盐酸、氢氧化钠、氯酸盐、次氯酸盐、漂白粉、金属钠,以及供盐析肥皂和鞣制皮革等。经高度精制的NaCl可用来制造生理盐水等。广泛用于临订治疗和生理实验,如失钠、失水、失血等情况。自然界中有盐矿,大量存在于海水和盐湖中。性质:式量58.44。食盐的主要成份。常见的有白色立方晶体或细小的结晶粉末。密度2.165克/厘米3。熔点801℃。沸点1413℃。味咸。溶于水,显中性。由浓缩海水结晶而制得,也可从天然的盐湖或盐井水制取。
(2)硫化钠:
①硫化钠遇酸反应,产生硫化氢。水溶液呈强碱性,故又称硫化碱。溶于硫黄生成多硫化钠。工业品因含杂质常为粉红、棕红色、土黄色块。有腐蚀性,有毒。在空气中易氧化生成硫代硫酸钠。
②硫化钠吸湿性很强,在100g水中的溶解度为15.4g(10℃),57.3g(90℃)。微溶于乙醇,不溶于乙醚。
③贮存方法:应放置通风、干燥处或石棉棚下。应防止雨淋和受潮。硫化碱潮解性大,又易氧化,容器必须密封。
(3)硫代硫酸钠:
①硫代硫酸钠,又名大苏打、海波,白色粉末,易溶于水。
②常用作照相定影剂
③是碘量法常用的还原剂
④与酸很容易歧化,生成气体和沉淀:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
钠的热点化合物:
叠氮酸钠(NaN3),类似于强碱弱酸盐。
氮化钠(Na3N),类盐,水解生成氢氧化钠和氨气,类似氮化镁、氮化钙、碳化钙等。
过硫化钠(Na2S2),具有类似过氧化钠的结构和化学性质。
高铁酸钠(Na2FeO4),具有强氧化性,还原产物为+3价铁的化合物。
(1)以铜锌原电池为例:
负极(Zn):Zn-2e-=Zn2+
正极(Cu):2H++2e-=H2↑
(2)正负极反应式的书写技巧:
①先确定原电池的正负极,在两极的反应物上标出相同数目的电子得失。
②根据物质放电后生成物的组成和电解质溶液中存在的离子,找到电极反应中还需要的其它离子。此时要注意溶液的酸碱性,从而判断应该是H+、OH-还是H2O参与了反应。因Zn反应后生成了Zn(OH)2,而KOH为电解质,可知负极上OH-参与了反应。MnO2生成了MnO(OH),即增加了氢元素,可知正极上有水参与了反应。
③根据电子守恒和电荷守恒写出电极反应式,即要注意配平和物质的正确书写形式,应按照离子方程式的书写要求进行。②中反应的电极反应式为:
负极:Zn+2OH--2e-=Zn(OH)2 正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
(若只要求写正极的反应式,也可以写成MnO2+H2O+e-=MnO(OH)+OH-)
原电池总反应式的书写:将正负电极反应相加,即为原电池总反应式。
原电池正、负极的判断方法:
原电池有两个电极,一个是正极,一个是负极,判断正极和负极的方法有以下几种。
1.由组成原电池的两极材料判断一般相对较活泼的金属为负极,相对不活泼的金属或能导电的非金属为正极。
2.根据电流方向或电子流动方向判断在外电路,电流由正檄流向负极;电子由负极流向正极
3.根据原电池里电解质溶液中离子的定向移动方向判断在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
4.根据原电池两极发生的变化来判断原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
5.X极增重或减轻工作后,X极质量增加,说明X极有物质析出,X 极为正极:反之,X极质量减少,说明X极金属溶解,X 极为负极
6.X极有气泡冒出工作后,x极上有气泡冒出,一般是发生了析出H,的电极反应,说明x极为正极。
7.X极附近pH的变化析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而工作后,X极附近pH增大了,说明X极为正极。
8.特例在判断金属活泼性的规律中,有一条为“当两种金属构成原电池时,活泼金属作负极,不活泼金属作正极”,但这条规律也有例外情况,如Mg和Al为原电池的两极,KOH为电解质溶液时,虽然Mg比Al活泼,但因Mg不和KOH反应,所以Mg作原电池的正极等。
电源:
化学电源化学电源是能够实际应用的原电池,化学电池是将化学能转变成电能的装置,它包括一次电池、二次电池和燃料电池等几大类。
一次电池:
(1)普通锌锰干电池构造简单,价格便宜,但放电时间短,放电后电压下降较快。
负极:
正极: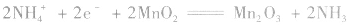
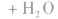
总反应式: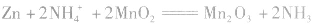
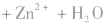
(2)碱性锌锰电池比普通锌锰干电池性能优越,比能量和可储存时间均有提高,适用于大电流和连续放电。负极是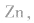 正极是
正极是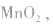 电解质是
电解质是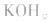
负极: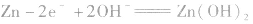
正极:
总反应式: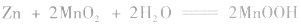
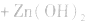
(3)锂电池
用金属锂作负极,石墨作止极,电解质溶液由四氯化铝锂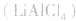 溶解在亚硫酰氯
溶解在亚硫酰氯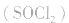 组成。
组成。
负极:
正极:
总反应式: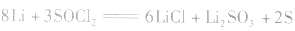
(4)锌银电池
负极是Zn,正极是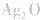 ,电解质是KOH。
,电解质是KOH。
负极: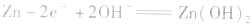
正极: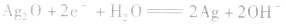
总反应式:
这种电池比能量大,电压稳定,储存时间长,适宜小电流连续放电,常制成纽扣式微型电池,广泛用于电子手表、照相机、计算器和其他微型电子仪器。
与“Li-SOCl2电池可用于心脏起博器。该电池的电极材料分别为锂和...”考查相似的试题有:
- 下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是[ ]A.Na和O2B.NaOH和CO2C.Na2O...
- 将金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的是( )A.HClB.K2SO4C.CuCl2D.饱和NaOH溶液
- 在标准状况下,将密度为(10/7)g/L CO2和CO混合气体充满一盛有足量Na2O2的密闭容器中(容积为22.4L,固体体积忽略不计),...
- 下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是[ ]A.Ba(OH)2B.Na2SO3C.NaHCO3D.NH4NO3
- 取a g某物质A,在氧气中完全燃烧,使燃烧产物跟足量过氧化钠反应,反应后固体的质量增加了b g。若b>a,则A为( )A.H2B.COC...
- 一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的...
- 用惰性电极电解下列各稀溶液,经一段时间后,溶液的pH值保持不变的是 A.AgNO3溶液B.NaCl溶液C.H2SO4溶液D.K2SO4溶液
- (10分)化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置。(1)把化...
- 氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为电池示意图,下列有关氢氧燃料电池的说法正确的是:A.该电池工作时电...
- 微生物燃料电池因具有原料广泛、操作条件温和、资源利用率高、对环境无污染等特点而被人们重视,以用葡萄糖作底物的燃料电池...