本试题 “下列有关金属的说法中,正确的是[ ]①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用②纯铁比生铁抗腐蚀性更强③单质铝在空气中比较耐...” 主要考查您对金属的化学腐蚀
金属的焰色反应
生活中的元素(常量元素、微量元素)
合金
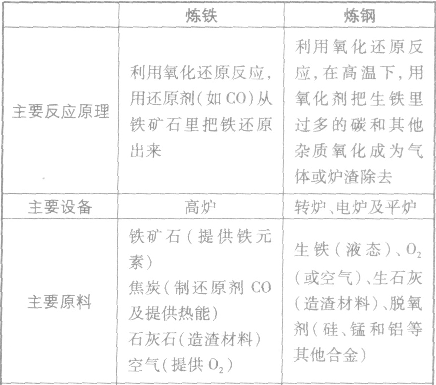
金属的冶炼
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 金属的化学腐蚀
- 金属的焰色反应
- 生活中的元素(常量元素、微量元素)
- 合金
- 金属的冶炼
金属的化学腐蚀:
1、定义:金属跟接触到的干燥气体(如O2、Cl2、SO2 等)或非电解质液体 (如石油)等直接发生化学反应而引起的腐蚀
2、条件:金属跟氧化剂直接接触
3、现象:无电流产生
4、本质:金属被氧化而腐蚀
5、反应速率:v(电化学腐蚀)>v(化学腐蚀)
(1)有些金属或它们的化合物在灼烧时会使火焰呈现出特色的颜色的想象。
(2)操作:
①洗:用盐酸洗去铂丝表面的杂质
②烧:将铂丝在酒精灯火焰上灼烧至于酒精灯颜色一致
③蘸:蘸取试样
④烧:在火焰上灼烧
⑤观:观察火焰颜色(若检验钾要透过钴玻璃观察)
(3)常见的颜色反应
Li Na K Ca Sr Ba Cu
紫红 黄 紫(透过蓝色钴玻璃片) 砖红 洋红 黄绿 绿
①焰色反应为物理变化过程。
②焰色现象与金属元素的存在有关,与物质组成无关。如:钠元素的焰色为黄色,包括钠单质以及钠的所有化合物。
常量元素人体中含量较多的元素有11种,它们约占人体质量的99.95%。在人体中含量超过0.01%的元素,称为常量元素。
①人体中的常量元素
| 元素名称 | 元素符号 | 质量分数% |
| 氧 | O | 65.0 |
| 碳 | C | 18.0 |
| 氢 | H | 10.0 |
| 氮 | N | 3.0 |
| 钙 | Ca | 2.0 |
| 磷 | P | 1.0 |
| 钾 | K | 0.35 |
| 硫 | S | 0.25 |
| 钠 | Na | 0.15 |
| 氯 | Cl | 0.15 |
| 镁 | Mg | 0.05 |
②一些常量元素在人体中的作用及每天适宜摄入量
| 钙 | 使骨骼和牙街具有坚硬的结构支架 | 800—1200mg | 缺钙主要影响骨骼的发育和结构,临床症状表现为青少年的佝偻病和成年人的骨质软化症及老年人的骨质疏松症。钙是无毒的元素,但摄入过量会导致高血钙,从而引起消化系统、泌尿系统等的疾病 | 海产品、豆类、奶类、各种绿叶蔬菜等 | 其中99%存在于骨骼和牙齿中,主要以羟基磷酸钙 [Ca10(PO4)6(OH)2晶体的形式存在 |
| 钠 | 细胞外液和细胞内液中的Na+和K+各自保持一定的浓度,维持人体内的水分和体液恒定的pH | 2000—2500mg | 缺钠会引起肌肉痉挛、头痛等;过量会引起水肿、高血压、贫血等 | 食盐 | 其中一半以Na+的形式存在于细胞外液中 |
| 钾 | 1850—5600mg | 缺钾会引起肌肉不发达、心律小齐等;过量会导致恶心、腹泻等 | 香蕉、柑橘、橙子、山楂、蘑菇、豆炎及其制品等 | 主要以K+的形式萍在干细胞内液中 | |
| 镁 | 促进骨骼发育、细胞遗传物质合成等 | 300—400mg | 缺镁会引起肌肉不发达、抽搐、痉挛、心律不齐等;过量会引起神经系统紊乱、肾病等 | 坚果、大豆、牛奶等 | 70%的镁以磷酸盐和碳酸盐形式参与骨骼和牙齿的组成,25%的镁存在于软组织中 |
微量元素:
在人体中含量在0.01%以下的元素。
①一些人体必需的微量元素
| 元素名称 | 元素符号 |
| 铁 | Fe |
| 钴 | Co |
| 铜 | Cu |
| 锌 | Zn |
| 铬 | Cr |
| 锰 | Mn |
| 钼 | Mo |
| 氟 | F |
| 碘 | I |
| 硒 | Se |
②一些必需微量元素对人体的作用及14—18岁人群每天的适宜摄入量
| 元素 | 人体内的含量 | 对人体的作用 | 适宜摄入量(每天) | 摄入量过高,过低对人体健康的影响 |
| 铁 | 4—5g | 是血红蛋白的成分,能帮助氧气的运输 | 20—50mg | 缺铁会引起贫血 |
| 锌 | 2.5g | 影响人体发育 | 15.5—19mg | 缺锌会引起食欲不振,生长迟缓,发育不良 |
| 硒 | 14—21mg | 有防癌、抗癌作用 | 50μg | 缺硒可能引起表皮角质化和癌症。如摄入量过高,会使人中毒 |
| 碘 | 25—50mg | 是甲状腺激素的重要成分 | 150μg | 缺碘会引起甲状腺肿大,幼儿缺碘会影响生长发育,造成思维迟钝。过量也会引起甲状腺肿大 |
| 氟 | 2.6g | 能防治龋齿 | 1.5mg | 缺氟易产生龋齿,过量会引起氟斑牙和氟骨病 |
合金的概念:
由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
合金的特性:
合金与各成分金属相比,具有许多优良的物理、化学和机械性能。
(1)合金的硬度一般比它的成分金属的大。
(2)合金的熔点一般比它的成分金属的低。
钢:
(1)钢和生铁同属于铁的合金。将铁矿石冶炼成生铁,生铁进一步冶炼可成为钢。
(2)钢是用量最大、用途最广的合金,按其化学成分可分为两大类:碳素钢和合金钢。
(3)碳素钢俗称普通钢。根据含碳量的多少,碳素钢又可以分为三类,见下表:
| 合金名称 | 含碳 | 主要性质 |
| 低碳钢 | <0.3% | 韧性、焊接性好,但强度低 |
| 中碳钢 | 0.3%~0.6% | 强度高,韧性及加工性好 |
| 高碳钢 | >0.6% | 硬而脆,热处理后弹性好 |
| 名称 | 其他主要合金元素 | 主要特性 | 主要用途 |
| 锰钢 | 锰 | 韧性好,硬度大 | 钢轨、轴承、钢磨、挖掘机铲斗、坦克装甲 |
| 不锈钢 | 铬、镍 | 抗腐蚀性好 | 医疗器械、容器、炊具等 |
| 硅钢 | 硅 | 导磁性好 | 变压器、发电机和电动机的铁芯 |
| 钨钢 | 钨 | 耐高温,硬度大 | 刀具 |
其他几种常见合金的主要成分,性能和用途:
| 合金 | 主要成分 | 主要性能 | 主要用途 |
| 球墨铸铁 | 铁,碳,硅,锰 | 机械强度好 | 在某些场合可代替钢 |
| 黄铜 | 铜,锌 | 强度高、可塑性 好、易加工、耐腐蚀 |
机器零件、仪表、日用品 |
| 青铜 | 铜,锡 | 强度高、可塑性好、 耐磨、耐腐蚀 |
机器零件如轴承、齿轮等 |
| 白铜 | 镍,铜 | 光泽好、耐磨、 耐腐蚀、易加工 |
钱币、代替银做饰品 |
| 焊锡 | 锡,铅 | 熔点低 | 焊接金属 |
| 硬铝 | 铝,铜,锰,镁,硅 | 强度和硬度好 | 火箭、飞机、轮船等制造业 |
| 钛合金 | 钛,铝,钒 | 耐高温、耐腐蚀、高强度 | 用于宇航、飞机、造船,化学工业 |
| 金合金 | 金,银,铜,稀土元素 | 有光泽、易加工、耐磨、耐腐蚀、易导电 | 金饰品、电子元件、钱币、笔尖 |
| Ti-Fe合金 | Ti,Fe | 室温下吸收H2快,且吸收H2量大,稍稍加热放H2速率快 | 储氢合金 |
合金的分类:
(1)铝合金:常见的有镁铝合金、硬铝等。硬铝密度小,强度高,具有较强的抗腐蚀能力,是制造飞机和字宙飞船的理想材料。
(2)铜合金
(3)
(4)新型合金:钛合金、耐热合金和形状记忆合金等。
几种有色金属材料的比较及新型金属材料:
1.金,银,铜的重要物理性质,性能及应用比较
| 金 | 银 | 铜 | ||
| 物理性质 | 颜色 | 黄色 | 银白色 | 紫红色 |
| 硬度 | Au<Ag<Cu | |||
| 延展性 | Au>Ag>Cu | |||
| 导电性 | Ag>Cu>Au | |||
| 导热性 | Ag>Cu>Au | |||
| 性能 | 极高的抗腐蚀性 | 催化,抗腐蚀性 | 在潮湿空气中易锈蚀 | |
| 应用 | 电子工业,航空,航天工业 | 有机合成,能源开发,医用材料制造 | 电气和电子工业,建筑材料 | |
2.新型金属材料
(1)铀(U)用作核电站反应堆的核燃抖
(2)镅(Am)在烟雾探测器中用作烟雾监测材料
(3)钛(Ti)被誉为“21世纪的金属”,是一种“亲生物金属”
金属资源的合理开发和利用:
1.合理开采矿物地球上的金属矿产资源是有限的,而且是不可再生的。随着人类不断地开发利用,矿产资源日渐减少,节约并合理地开采矿产资源是合理利用金属资源最直接,最基本水的措施
2.防止金属腐蚀金属制品在使用过程中会因腐蚀而损坏,每年因腐蚀造成的钢铁资源损失占当年总产量的10%以上,因此防腐是避免金属资源损失、浪费的重要手段
3.回收和利用废旧金属回收的废旧金属制品,大部分可以重新制成金属或它们的化合物,再进行使用。例如废旧钢铁可以用于炼钢;废铁屑可用于制铁盐
4.寻找金属替代品随着金属资源的目益减少,利用可再生资源开发、研制出新型材料代替金属材料的应用,是当今社会的一项重要科研课题,例如已经研制出并已实际运用的高硬度、耐高温材料;新型的替代钢铁的无机非金属材料料;有机化工合成的各种强度的橡胶、塑料,复合材料等
(1)把金属从化合态变为游离态。常用冶炼法:用碳一氧化碳氢气等还原剂与金属氧化物在高温下反应。
(2)冶炼的原理
①还原法:金属氧化物(与还原剂共热)--→游离态金属
②置换法:金属盐溶液(加入活泼金属)--→游离态金属
③火法冶炼(Pyrometallurgy)又称为干式冶金,把矿石和必要的添加物一起在炉中加热至高温,熔化为液体,生成所需的化学反应,从而分离出粗金属,然后再将粗金属精炼。
④湿式冶金(Hydrometallurgy) 湿法冶金这种冶金过程是用酸、碱、盐类的水溶液,以化学方法从矿石中提取所需金属组分,然后用水溶液电解等各种方法制取金属。此法主要应用在低本位、难熔化或微粉状的矿石。现在世界上有75%的锌和镉是采用焙烧-浸取-水溶液电解法制成的。这种方法已大部分代替了过去的火法炼锌。其他难于分离的金属如镍-钴,锆-铪,钽-铌及稀土金属都采用湿法冶金的技术如溶剂萃取或离子交换等新方法进行分离,取得显著的效果。
(3)常见金属冶炼:
①汞:热分解法:2HgO
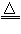 2Hg+O2(气体)
2Hg+O2(气体) ②铜:置换法:CuSO4+Fe==Cu+FeSO4(又叫湿法炼铜)
③铝:电解法:2Al2O3
 4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)
4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)④镁:电解法:MgCl2(l)
 Mg(s)+Cl2(g)↑
Mg(s)+Cl2(g)↑ ⑤钠:电解法:2NaCl
 2Na+Cl2↑
2Na+Cl2↑ ⑥钾:原理是高沸点金属制低沸点金属:Na+KCl==K+NaCl(反应条件是高温,真空。)
⑦铁:热还原法:2Fe2O3+3C
 2Fe+3CO2↑
2Fe+3CO2↑ 炼铁和炼钢的比较:

铝的冶炼:
(1)由铝土矿制氧化铝
①将铝土矿中的氧化铝水合物溶解在氢氧化钠溶液中: 
②向偏铝酸钠溶液中通入二氧化碳,析出氢氧化铝: 
③使氢氧化铝脱水生成氧化铝:
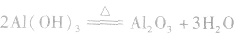
(2)电解氧化铝制备铝
电解时,以氧化铝、冰晶石(Na2AlF6)熔融液为电解质,其中也常加入少量的氟化钙等帮助降低熔点;阳极和阴极以碳素材料做成,在电解槽的钢板和阴极碳素材料之间还要放置耐火绝缘材料。
①主要设备——电解槽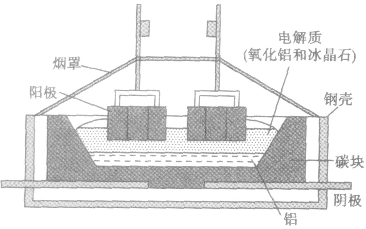
②电极反应式
阳极反应: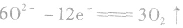
阴极反应: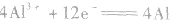
总反应:
与“下列有关金属的说法中,正确的是[ ]①在人类对金属材料的使用...”考查相似的试题有:
- 下列有关物质性质或应用的说法正确的是( )A.二氧化锰具有强氧化性,能将双氧水氧化为氧气B.炭具有强还原性,高温下能将二...
- 常温下,下列各组物质相混合时不能产生气体的是( )A.铁与浓硫酸B.铝与稀硫酸C.铝与氢氧化钠D.大理石与盐酸
- 不能实现下列物质间直接转化的元素是A.硫B.碳C.硅D.钠
- 人体缺碘会影响正常的生命活动。为提高人体素质,食盐加碘、食物补碘已引起人们的重视。据报道,人从食物中摄取碘后碘便在甲...
- 下列说法正确的是( )A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在B.检验红砖中的氧化铁成分,向红砖粉末中加入...
- 化学与生活息息相关,以下做法不正确的是( )A.用聚乙烯塑料薄膜包装食品B.工业废水、生活污水不经处理直接排放C.食用蛋...
- 下列图示的实验能达到实验目的的是A.图①实验装置可验证非金属性:S>C>SiB.图②实验装置收集NO2气体C.图③实验装置可制备、收...
- (6分)某些化学反应可用下式表示:A + B= C + D + H2O请回答下列问题:(1)若A、D均可用于消毒,且C是家家户户的厨房必备...
- 下列物质露置在空气中放置不易变质的是 A.硫化钠B.硅酸钠C.NaClD.氧化钙
- 下列有关金属及其合金的说法不正确的是[ ]A.目前我国流通的硬币是由合金材料制造的B.生铁、普通钢和不锈钢中的碳含量依次增...