本试题 “某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96 g的该结晶水合物,分别加水溶解。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿...” 主要考查您对氧化还原反应的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的计算
氧化还原反应的计算:
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
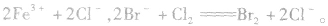 。
。
发现相似题
与“某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1...”考查相似的试题有:
- 已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1 mol 氧化剂在反应中得到的电子为[ ]A.10 molB...
- (1)金属加工后的废弃液中含2%~5%的NaNO2,它是一种环境污染物.人们用NH4Cl溶液来处理此废弃液,使 NaNO2溶液转化为无毒物...
- 下列反应可用于检查驾驶员是否酒后驾车。试在横线上填写所缺物质的结构简式(不必配平):_K2Cr2O7+_CH3CH2OH+_H2SO4→(橙红...
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过...
- MnO2+4HCl(浓)═MnCl2+Cl2+2H2O 中氧化剂______,还原剂______,氧化产物______,转移电子______.
- 下列说法正确的是( )A.4.0g碳化硅晶体中所含C-Si数为0.4NAB.PCl3、BF3、HClO这些分子中每个原子都达到了8电子结构C.电解...
- 亚硝酸(HNO2)是一种比醋酸略强的弱酸,很不稳定,易发生自身氧化还原反应而分解。(1)低温下,将等物质的量的NO和NO2通入水中...
- Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为1:2,则反应...
- 在口KClO3+口HCl(浓)=口KCl+口Cl2↑+口H2O的反应中,(1)配平该化学方程式,各物质前化学计量数分别是______,______,____...
- 用0.1 mal/L的Na2SO3溶液30 mL,恰好将2×10-3mol的XO4-还原,则元素X在还原产物中的化合价[ ]A.+1B.+2C.+3D.+4