本试题 “化学物质就在我们身边,下面是厨房了常用的化学物质,用它们的序号填空。①食醋 ②纯碱 ③天然气 属于化石燃料的是 其水溶液PH<7的是 。属于盐类物质的是” 主要考查您对化石燃料
酸、碱、盐
溶液的酸碱性与pH值
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化石燃料
- 酸、碱、盐
- 溶液的酸碱性与pH值
概念:
化石燃料是由古代动植物的遗骸经过一系列复杂变化而形成的。化石燃料包括煤(工业的粮食),石油(工业的血液)和天然气,是不可再生能源。
煤:
①煤是固体燃料,其最大的缺点是燃烧速率慢,利朋效率低,且不适用于多数运输业作动力源,还会导致严重的大气污染。从资源、经济与环境三方面综合考虑,适宜在煤产地搞热电联产,提高煤炭转换成电能的比重.住城市发展煤气或液化燃料。煤的综合利用煤是我国主要的化石能源,占90%以上,煤的综合利用措施主要有下列三条:
a.煤的气化:目前主要是煤在高温下与水蒸气的反应。产物为燃料气,又可作化工原料。主要产品有CO、CH4、H2等。
b.煤的焦化:也称煤的干馏,是在隔绝空气的条件下加强热.使组成煤的物质发生分解反应。主要产品及用途:焦炭:金属冶炼;煤焦油:重要的化工原料;焦炉气:含有CO、CH4、H2等,既可作燃料又是重要的化工原料。
c. 煤的液化:煤发生化学反应,分裂为小分子,利用催化剂向小分子中加入氯元素.得到与石油产品成分相近的燃料油,是一项人造石油的技术。
②煤气:
a.煤气的形成:煤气作为一种生活燃料,在一些城市被使用.煤气通常情况下是利用煤与水蒸气在高温条件反应生成的:C+H2O CO+H:煤气的主要成分是CO,但同时含有H2、CH4等其他可燃性气体
CO+H:煤气的主要成分是CO,但同时含有H2、CH4等其他可燃性气体
b.煤气中报警物质的特性:由于煤气的主要成分CO是一种无色、无味的有毒气体,当煤气泄漏时不易察觉,会危害人体健康甚至危及生命。为了安全起见,通常在煤气中加入一些持殊的物质,如乙硫醇(C2H5SH)。乙硫醇具有特殊刺激性气味,当煤气泄漏时,可以使人很快警觉,并马上采取措施,防止发生爆炸、火灾和中毒事故;同时,乙硫醇在煤气燃烧过称中可以充分燃烧不仪煤气.其他可燃性气体如天然气、液化石油气中通常也加入少量报警物质。
石油的综合利用:
①石油是由多种物质组成的混合物,没有同定的组成和性质,根据组成石油的各组分的沸点不同,可从石油中分离出不同的燃料,如汽油、煤油、液化石油气等,
②石油分馏产品及用途
溶剂油——溶剂
汽油—一汽车燃料
航空煤油一一飞机燃料
柴油一—拖拉机、轮船燃料
润滑油一一润滑剂
石蜡——蜡烛
沥青——筑路
石油不仅是优质的能量来源,还是宝贵的化工资源。使石油中的大分子断裂为小分子.小分子重新组合成大分子,从而把石油转化为工农业、医疗、化工等产品,因此把石油称怍“工业的血液”。石油化学工业不同于石油分离,石油化学工业是石油发生复杂的反应,从而生成各种产品,是化学变化。
天然气:
天然气的主要成分是甲烷,主要含碳、氢两种元素。天然气里的甲烷是在隔绝空气的情况下,主要由植物残体分解而生成的。有石油的地方,一般就有天然气。天然气是一种重要的气体燃料。但其贮藏量是有限的。
①甲烷的组成
甲烷是由碳、氢两种元素组成的化合物,其化学式为CH4,是一种最简单的有机物,其中含氢元素的质量分数为25%,是氢元素含量最高的有机物。
②甲烷的性质
a. 物理性质:无色,无味的气体,极难溶于水,它的密度比空气小。
b. 化学性质——可燃性
纯净的甲烷在空气中能安静地燃烧在火焰上方罩一冷而干燥的小烧杯,然后再换一个内壁有石灰水的小烧杯。
现象:烧杯内壁有水珠生成,烧杯内壁的石灰水变浑浊。
结论:甲烷中含有碳元素和氢元素,是由碳和氢两种元素组成的化合物,化学式为CH4。
化学方程式:CH4+O2 CO2+H2O
CO2+H2O
c. 当甲烷与氧气或空气混合后,点燃就有发生爆炸的危险(按体积计算爆炸极限为5%—15%),所以在煤矿的矿井里必须采取通风,严禁烟火等安全措施,以防甲烷和空气等混合发生爆炸。
煤,石油,天然气的区别
化石燃料燃烧与环境的关系:
①化石燃料燃烧产生的物质
化石燃料煤、石油和天然气都是含碳元素的物质.其中还含硫元素等杂质。这些燃料燃烧时,会产生二氧化硫等污染空气的气体,燃料燃烧不充分,会产生一氧化碳和碳粒,加上未燃烧的碳氢化合物,如果直接排放到空气中必然对空气造成污染化石燃料燃烧时排放出的物质有:
a.一氧化碳:
b.碳氢化合物;
c.碳粒和尘粒;
d.二氧化碳
②煤燃烧产生的有害物质
由于煤所含元素有C、H、N、S、O等几种,所以煤燃烧时会排放出二氧化硫、氮的氧化物等.这些气体溶于水会形成酸雨,酸雨会对森林、雕像、建筑物等造成腐蚀。当煤未充分燃烧时,会产生一氧化碳,一氧化碳是夺气的污染物。煤在燃烧时,会散出固体小颗粒(未燃烧的碳粒),造成对空气的粉尘污染。家庭里用煤炉烧煤时,常常会闻到一股激性气味,并看到炉口上方蓝色火焰、这种刺激气昧是烧煤时产生的二氧化硫的气味,蓝色火焰主要是生成的一氧化碳燃烧而产生的。二氧化碳的大量排放,超过自然界的消耗能力,就会引起温室效应,会使大气变暖,陆地减少。
③减少煤燃烧污染的措施
a.燃烧低硫优质煤,或是采用燃料脱硫技术.减少SO2的排放;
b.尽量使燃料完全燃烧;
c.减少化石燃料的使用,开发新能源:
d.植树造林;
e.变分散供热为集中供热。
④汽车用燃料燃烧对空气的影响及减少空气污染的措施
化石燃料的使用与开发:
现有的化石燃料是有限的,而且是不可再生的,每种化石燃料都确有用尽的时候。下表是我同1998年探明的化石燃料储量及产量和使用年限
从表中数据可以看出,节约能源是完全有必要的,也是十分重要的
节约能源,充分利用能源,使燃料充分燃烧,可从以下两个方面着手:
①燃烧时要有足够的空气;
②燃料与空气要有足够大的接触面积,充足的空气才能使燃料尽可能完全燃烧,与空气充分接触才能使其反应快,对能量的利用损失小,
化石燃料是由古代动植物的遗骸经过一系列复杂变化而形成的。化石燃料包括煤(工业的粮食),石油(工业的血液)和天然气,是不可再生能源。
煤:
①煤是固体燃料,其最大的缺点是燃烧速率慢,利朋效率低,且不适用于多数运输业作动力源,还会导致严重的大气污染。从资源、经济与环境三方面综合考虑,适宜在煤产地搞热电联产,提高煤炭转换成电能的比重.住城市发展煤气或液化燃料。煤的综合利用煤是我国主要的化石能源,占90%以上,煤的综合利用措施主要有下列三条:
a.煤的气化:目前主要是煤在高温下与水蒸气的反应。产物为燃料气,又可作化工原料。主要产品有CO、CH4、H2等。
b.煤的焦化:也称煤的干馏,是在隔绝空气的条件下加强热.使组成煤的物质发生分解反应。主要产品及用途:焦炭:金属冶炼;煤焦油:重要的化工原料;焦炉气:含有CO、CH4、H2等,既可作燃料又是重要的化工原料。
c. 煤的液化:煤发生化学反应,分裂为小分子,利用催化剂向小分子中加入氯元素.得到与石油产品成分相近的燃料油,是一项人造石油的技术。
②煤气:
a.煤气的形成:煤气作为一种生活燃料,在一些城市被使用.煤气通常情况下是利用煤与水蒸气在高温条件反应生成的:C+H2O
 CO+H:煤气的主要成分是CO,但同时含有H2、CH4等其他可燃性气体
CO+H:煤气的主要成分是CO,但同时含有H2、CH4等其他可燃性气体 b.煤气中报警物质的特性:由于煤气的主要成分CO是一种无色、无味的有毒气体,当煤气泄漏时不易察觉,会危害人体健康甚至危及生命。为了安全起见,通常在煤气中加入一些持殊的物质,如乙硫醇(C2H5SH)。乙硫醇具有特殊刺激性气味,当煤气泄漏时,可以使人很快警觉,并马上采取措施,防止发生爆炸、火灾和中毒事故;同时,乙硫醇在煤气燃烧过称中可以充分燃烧不仪煤气.其他可燃性气体如天然气、液化石油气中通常也加入少量报警物质。
石油的综合利用:
①石油是由多种物质组成的混合物,没有同定的组成和性质,根据组成石油的各组分的沸点不同,可从石油中分离出不同的燃料,如汽油、煤油、液化石油气等,
②石油分馏产品及用途
溶剂油——溶剂
汽油—一汽车燃料
航空煤油一一飞机燃料
柴油一—拖拉机、轮船燃料
润滑油一一润滑剂
石蜡——蜡烛
沥青——筑路
石油不仅是优质的能量来源,还是宝贵的化工资源。使石油中的大分子断裂为小分子.小分子重新组合成大分子,从而把石油转化为工农业、医疗、化工等产品,因此把石油称怍“工业的血液”。石油化学工业不同于石油分离,石油化学工业是石油发生复杂的反应,从而生成各种产品,是化学变化。
天然气:
天然气的主要成分是甲烷,主要含碳、氢两种元素。天然气里的甲烷是在隔绝空气的情况下,主要由植物残体分解而生成的。有石油的地方,一般就有天然气。天然气是一种重要的气体燃料。但其贮藏量是有限的。
①甲烷的组成
甲烷是由碳、氢两种元素组成的化合物,其化学式为CH4,是一种最简单的有机物,其中含氢元素的质量分数为25%,是氢元素含量最高的有机物。
②甲烷的性质
a. 物理性质:无色,无味的气体,极难溶于水,它的密度比空气小。
b. 化学性质——可燃性
纯净的甲烷在空气中能安静地燃烧在火焰上方罩一冷而干燥的小烧杯,然后再换一个内壁有石灰水的小烧杯。
现象:烧杯内壁有水珠生成,烧杯内壁的石灰水变浑浊。
结论:甲烷中含有碳元素和氢元素,是由碳和氢两种元素组成的化合物,化学式为CH4。
化学方程式:CH4+O2
 CO2+H2O
CO2+H2Oc. 当甲烷与氧气或空气混合后,点燃就有发生爆炸的危险(按体积计算爆炸极限为5%—15%),所以在煤矿的矿井里必须采取通风,严禁烟火等安全措施,以防甲烷和空气等混合发生爆炸。
煤,石油,天然气的区别
| 煤 | 石油 | 天然气 | |
| 形成 | 古代植物被埋在地下经过一系列复杂变化而形成 | 古代植物遗骸在地壳中经过复杂变化而形成 | |
| 元素组成 | 主要含C;少量含:H、N、S、O等 | 主要含C、H,少量含S、N、O | 主要含C、H,主要成分是CH4 |
| 类别 | 混合物(由有机物和无机物组成) | 混合物(多种有机物) | 混合物 |
| 形态 | 黑色固体,有光泽,人称“黑色金子”,无固定的熔点,沸点,具有可燃性 | 粘稠液体,黑色或棕色,不溶于水,密度比水小,无固定的熔点,沸点 | 无色无味气体,密度比空气小,极难溶于水 |
| 性质 | 煤 焦炭,煤焦油、煤气等 焦炭,煤焦油、煤气等 |
石油 溶剂油,汽油,航空煤油,煤油,柴油等 溶剂油,汽油,航空煤油,煤油,柴油等 |
易燃烧,产生明亮的蓝色火焰,化学方程式为CH4+2O2 CO2+2H2O CO2+2H2O |
化石燃料燃烧与环境的关系:
①化石燃料燃烧产生的物质
化石燃料煤、石油和天然气都是含碳元素的物质.其中还含硫元素等杂质。这些燃料燃烧时,会产生二氧化硫等污染空气的气体,燃料燃烧不充分,会产生一氧化碳和碳粒,加上未燃烧的碳氢化合物,如果直接排放到空气中必然对空气造成污染化石燃料燃烧时排放出的物质有:
a.一氧化碳:
b.碳氢化合物;
c.碳粒和尘粒;
d.二氧化碳
②煤燃烧产生的有害物质
由于煤所含元素有C、H、N、S、O等几种,所以煤燃烧时会排放出二氧化硫、氮的氧化物等.这些气体溶于水会形成酸雨,酸雨会对森林、雕像、建筑物等造成腐蚀。当煤未充分燃烧时,会产生一氧化碳,一氧化碳是夺气的污染物。煤在燃烧时,会散出固体小颗粒(未燃烧的碳粒),造成对空气的粉尘污染。家庭里用煤炉烧煤时,常常会闻到一股激性气味,并看到炉口上方蓝色火焰、这种刺激气昧是烧煤时产生的二氧化硫的气味,蓝色火焰主要是生成的一氧化碳燃烧而产生的。二氧化碳的大量排放,超过自然界的消耗能力,就会引起温室效应,会使大气变暖,陆地减少。
③减少煤燃烧污染的措施
a.燃烧低硫优质煤,或是采用燃料脱硫技术.减少SO2的排放;
b.尽量使燃料完全燃烧;
c.减少化石燃料的使用,开发新能源:
d.植树造林;
e.变分散供热为集中供热。
④汽车用燃料燃烧对空气的影响及减少空气污染的措施
| 燃料燃烧对空气的影响 | 减少空气污染的措施 | |
| 汽车用燃料的燃烧 | 汽车使用的燃料 (汽油或柴油)燃烧产生的尾气中,主要污染物有一氧化碳、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘等 | ①改进发动机的燃烧方式,使汽油或柴油充分燃烧;②使用催化净化装置,使有害气体转化为无害物质;④使用无铅汽油。禁止含铅物喷排放,同时在管理上加入检测尾气的力度等 |
化石燃料的使用与开发:
现有的化石燃料是有限的,而且是不可再生的,每种化石燃料都确有用尽的时候。下表是我同1998年探明的化石燃料储量及产量和使用年限
| 探明储量 | 年产量 | 使用年限 | |
| 石油 | 32.7亿吨 | 1.6亿 | 约20年 |
| 天然气 | 1.37×104亿立方米 | 217亿立方米 | 约63年 |
| 煤 | 1145亿吨 | 12.4亿 | 约92年 |
节约能源,充分利用能源,使燃料充分燃烧,可从以下两个方面着手:
①燃烧时要有足够的空气;
②燃料与空气要有足够大的接触面积,充足的空气才能使燃料尽可能完全燃烧,与空气充分接触才能使其反应快,对能量的利用损失小,
酸:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
| 从化学组成看 | 从电离观点看 | 组成特点 | |
| 酸 | 由氢元素和酸根组成 | 电离时生成的阳离子全都是氢离子(H+)的化合物 | 一定含氢元素 |
| 碱 | 由金属元素和氢氧根组成(氨水也是碱) | 电离时生成的阴离子全都是氢氧根离子(OH-)的化合物 | 一定含氢、氧 元素 |
| 盐 | 含有金属元素(或NH4+) 和酸根 | 电离时能生成金属离子(或NH4+)和酸根离子的化合物 | 酸式盐中一定含氢元素,碱式盐中一定含氢、氧元素 |
溶液的酸碱度及表示方法
1. 溶液的酸碱性:溶液呈酸性、碱性或中性,通常用指示剂来测定。
2. 溶液的酸碱度:指溶液酸碱性的强弱程度,即酸碱度是定量表示溶液酸碱性强弱的一种方法.溶液的酸碱度通常用pH表示。
3. pH的范围:0—14
溶液酸碱度和pH值的关系
| 溶液的pH值 | 溶液的酸碱度 |
| <7 | 酸性溶液(pH越小,酸性越强) |
| =7 | 中性溶液 |
| >7 | 碱性溶液(pH越大,碱性越大) |
(2)粗略测定溶液的酸碱度常用pH试纸。
pH的测定方法:
测定溶液pH通常用pH试纸和pH计。其中用pH试纸测定溶液pH的具体操作为:测定时,将pH试纸放在表面皿上,用干净的玻璃棒蘸取被测溶液并滴在pH试纸上,半分钟后把试纸显示的颜色与标准比色卡对照,读出溶液的pH,简记为:“一放、二蘸、三滴、四比”。
改变溶液pH的方法:
溶液的pH实质是溶液中H+浓度或OH-浓度大小的外在表现。改变溶液中H+浓度或OH-浓度,溶液的pH就会发生改变。
方法一加水:只能改变溶液的酸碱度,不能改变溶液的酸碱性,即溶液的pH只能无限地接近于7。
①向酸性溶液中加水,pH由小变大并接近7,但不会等于7,更不会大于7(如下图所示)。
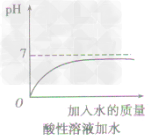
②向碱性溶液中加水,pH由大变小并接近于7,但不会等于7,更不会小于7(如下图所示)。

方法二加酸碱性相同,pH不同的溶液:原溶液酸碱性不会发生变化,但混合后溶液的pH介于两种溶液之间:
方法三加酸碱性相反的溶液:混合后发生中和反应,溶液的pH可能等于7,若加入的溶液过量,原溶液的酸碱性就会与原来相反(如下图所示)。

pH值测定时的注意事项:
①不能直接把pH试纸浸入待测的溶液中,以免带入杂质,同时还可能溶解pH试纸上的一部分指示剂,致使比色时产生较大误差。
②不能先用水将pH试纸润湿再进行测定。因为将待测溶液滴到用水润湿后的pH试纸上,其溶质质量分数将变小。
③用pH试纸测得溶液的pH一般为整数。
了解溶液的酸碱度的重要意义:
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中.农作物一般适宜在pH为7或接近于7的土壤中生长;
③测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况;
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
身边一些物质的pH:

发现相似题
与“化学物质就在我们身边,下面是厨房了常用的化学物质,用它们...”考查相似的试题有:
- 生活中处处有化学.请根据你所学的化学知识,判断下列说法错误的是( )A.为防止流感传染,可将教室门窗关闭后,用食醋熏蒸...
- 与北京奥运相比,上海世博会将扩大各类新能源车的运用,约1000辆新能源汽车将为世博服务。其中,约500辆车为超级电容车、纯电...
- 形态各异的物质可按一定规律分类(用序号填空):A.盐酸B.氯化钾C.氢氧化钙D.甲烷E.五氧化二磷F.氮气题号物质分类标准...
- 科学家研发出一种以甲醇、氢氧化钾( KOH)为原料,用于手机的高效燃料电池。氢氧化钾( KOH)属于[ ]A.酸B.碱C.盐D.氧化物
- 对下列物质:①小苏打;②苛性钠;③蔗糖水;④盐酸;⑤氯酸钾.等分类正确的是( )A.盐③⑤B.碱①②C.混合物③④D.化合物①②③④⑤
- 许多化学反应在生产生活中有重要应用.(1)用X射线检查肠胃疾病时,要让患者服用“钡餐”(主要成分是硫酸钡,硫酸钡难溶于水...
- 分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。从组成分类来看,Na2SO4不属于[ ]A.化...
- 下列叙述错误的是[ ]A.工业上的“三酸两碱”指的是盐酸、硫酸、硝酸、烧碱、熟石灰B.生铁投入足量的盐酸中充分反应后会留下黑色...
- 感受厨房中的科学--根据你的生活体验,下列叙述符合实际的是( )A.食用山茶油的密度为2.0×103千克/米3B.食醋的pH<7C.白...
- 下列物质呈中性的是( )A.食盐水pH=7B.炉具清洁剂pH=12C.酱油pH=4D.柠檬汁pH=3