本试题 “镁及其合金是用途广泛的金属材料,目前世界上60%的镁是从海水中提取的。.某学校课外兴趣小组从海水晒盐后的盐卤(主要含等)中模拟工业生产来提取镁,主要过...” 主要考查您对其他物质的制备(硫酸铜晶体、铁红等)
海水资源的综合利用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 其他物质的制备(硫酸铜晶体、铁红等)
- 海水资源的综合利用
实验室制取甲烷(CH4):
(1)反应原理:CH3COONa+NaOH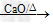 CH4+Na2CO3
CH4+Na2CO3
(2)发生装置:固+固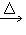 气
气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4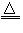 Na2SO4+2HCl?
Na2SO4+2HCl?
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
五水硫酸铜的制备:
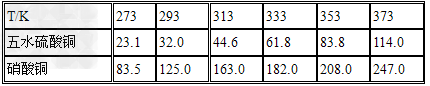
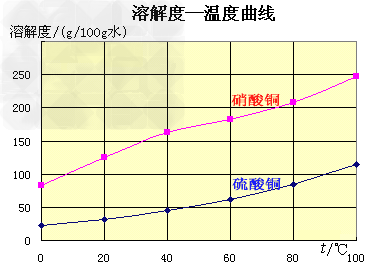
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
(1)反应原理:CH3COONa+NaOH
 CH4+Na2CO3
CH4+Na2CO3(2)发生装置:固+固
 气
气 (3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4
 Na2SO4+2HCl?
Na2SO4+2HCl?(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
五水硫酸铜的制备:
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。


(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
海水资源的综合利用:
浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
海水制盐:
(1)海水制盐的方法:从海水中得到食盐的方法有蒸发法(盐田法)、电渗析法等。目前,以蒸发法(盐田法)为主。
(2)海水晒盐的基本原理:水分不断蒸发,氯化钠等盐结晶析出。
(3)海水晒盐的流程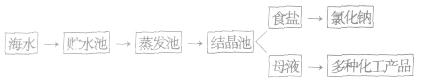
氯碱工业:
(1)食盐水的精制
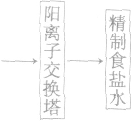
(2)电极反应
阴极: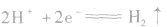
阳极:
总反应: :
:
(3)主要设备
离子交换膜电解槽一一阳极用金属钛(表面涂有钛、钉氧化物层)制成,阴极用碳钢(覆有镍镀层)制成。阳离子膜具有选择透过性,只允许Na+透过,而Cl-、 OH一和气体不能透过。 
(4)产品及用途
烧碱:可用于造纸、玻璃、肥皂等工业
氯气:可用于制农药、有机合成、氯化物的合成
氢气:可用于金属冶炼、有机合成、盐酸的制取
海水提溴:
(1)氯化
氯化氧化溴离子,在pH=3.5的酸性条件下效果最好,所以在氯化之前要将海水酸化。
(2)吹出
当海水中的Br一被氧化成Br2以后,用空气将其吹出。另外,也可以用水蒸气,使溴和水蒸气一起蒸出。
(3)吸收
目前比较多的是用二氧化硫作还原剂,使溴单质转化为HBr,再用氯气将其氧化得到溴产品。化学方程式如下: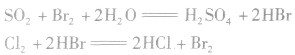
海水提镁:
(1)工艺流程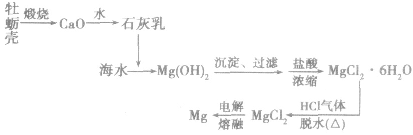
(2)主要化学反应
①制备石灰乳: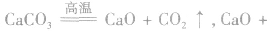
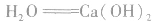
②沉淀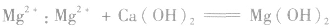
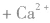
③制备
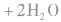
从海水中提取重水:
提取重水的方法:蒸馏法、电解法、化学交换法、吸附法等。常用方法:化学交换法(硫化氢一水双温交换法)
铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义,化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能也是越来越受到重视的新型能源。
发现相似题
与“镁及其合金是用途广泛的金属材料,目前世界上60%的镁是从海水...”考查相似的试题有:
- (14分)盐酸、硝酸都是用途相当广泛的两种酸。(1)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加...
- (14分)实验室制NO及验证NO的性质,可以用如图所示的装置。请根据提示完成以下问题。已知反应:1.NO的制备(1)在加药品之前...
- 为了证明CO具有还原性,有人利用下列装置设计了系列的实验,其中A为气体发生装置,C为尾气处理装置,X装置可以盛放不同的试剂...
- 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下请回答下列问题:(...
- 钢铁工业已成为我国重要的支柱产业。某大型铁矿附近有炼焦煤、石灰石、黏土矿和丰富的水资源。(1)随着铁矿的开发,该地建立了...
- 请回答氯碱的如下问题:(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表...
- 下列化学工业有关设备、原料、反应条件配套的是 ( )A.联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30 ℃~35 ℃...
- 镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的.主要步骤如下:试回答下列问题:(1)为了使MgSO4...
- 下列有关工业生产的叙述中,正确的是( )A.海水提镁:B.海水提溴:C.工业制硫酸:D.工业合成氨:
- 柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产...