本试题 “在一定条件下,发生如下反应:;(1)该反应中的含义是(填序号):___________。①该反应达到平衡时放出的热量②该反应达到平衡时吸收的热量③该条件下,与反应生...” 主要考查您对焓变、反应热
影响化学反应速率的因素
等效平衡
影响化学平衡的因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 焓变、反应热
- 影响化学反应速率的因素
- 等效平衡
- 影响化学平衡的因素
反应热,焓变:
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
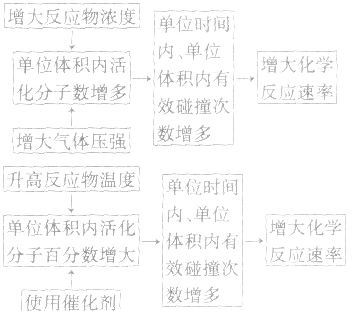
影响化学反应速率的因素:
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为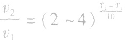
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
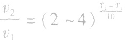
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释

等效平衡的定义:
在一定条件下,只是起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的百分含量(体积、物质的量)均相同,这样的平衡互称等效平衡
等效平衡规律:
(1)在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应,只改变起始时加入物质的物质的量,如果按化学方程式的化学计量关系转化为化学方程式中同一半边的物质,其物质的量与对应组分的起始加入量相同,则建立的化学平衡是等效的
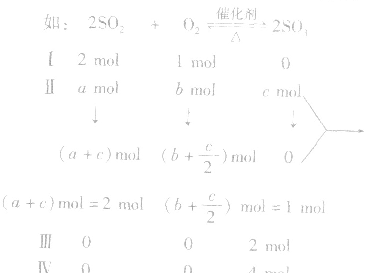
恒温、恒容时,I、Ⅱ、Ⅲ这三种情况下达到的平衡完全等效。IV与I、Ⅱ、Ⅲ不等效。
(2)在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,改变起始时加入物质的物质的量,如果按化学方程式的化学计量关系转化为化学方程式同一半边的物质,其物质的量比与对成组分的起始加入量比相同,则建立的化学平衡是等效的。
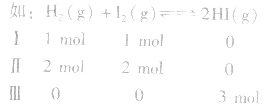
I、Ⅱ、Ⅲ形成等效平衡,此处等效的含义是各物质的体积分数相同,同时,混合气体的平均摩尔质量 也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。
也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。
(3)在恒温、恒压条件下,改变起始时加入物质的物质的量,如果按化学计量数换算成化学方程式同一半边的物质,其物质的量之比与对应组分的起始加入量之比相同,则建立的化学平衡等效。
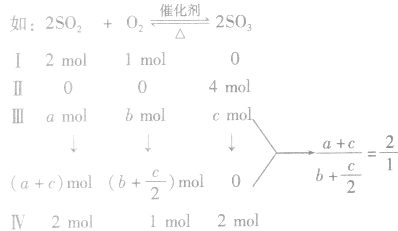
I、Ⅱ、Ⅲ、Ⅳ形成等效平衡。说明等效平衡分析方法:“一边倒”——按化学计量关系将生成(反应)物全部转化为反应(生成) 物后再看是否相同或成比例。
在一定条件下,只是起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的百分含量(体积、物质的量)均相同,这样的平衡互称等效平衡
等效平衡规律:
(1)在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应,只改变起始时加入物质的物质的量,如果按化学方程式的化学计量关系转化为化学方程式中同一半边的物质,其物质的量与对应组分的起始加入量相同,则建立的化学平衡是等效的
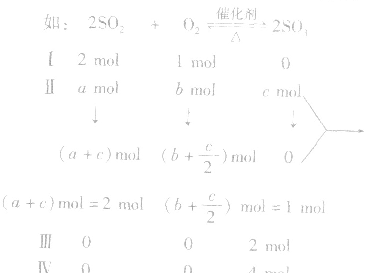
恒温、恒容时,I、Ⅱ、Ⅲ这三种情况下达到的平衡完全等效。IV与I、Ⅱ、Ⅲ不等效。
(2)在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,改变起始时加入物质的物质的量,如果按化学方程式的化学计量关系转化为化学方程式同一半边的物质,其物质的量比与对成组分的起始加入量比相同,则建立的化学平衡是等效的。
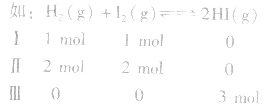
I、Ⅱ、Ⅲ形成等效平衡,此处等效的含义是各物质的体积分数相同,同时,混合气体的平均摩尔质量
 也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。
也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。(3)在恒温、恒压条件下,改变起始时加入物质的物质的量,如果按化学计量数换算成化学方程式同一半边的物质,其物质的量之比与对应组分的起始加入量之比相同,则建立的化学平衡等效。

I、Ⅱ、Ⅲ、Ⅳ形成等效平衡。说明等效平衡分析方法:“一边倒”——按化学计量关系将生成(反应)物全部转化为反应(生成) 物后再看是否相同或成比例。
影响化学平衡的因素:
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应 来说,加压,
来说,加压,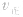 增大、
增大、 增大,
增大,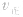 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,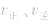 均减小,
均减小,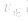 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
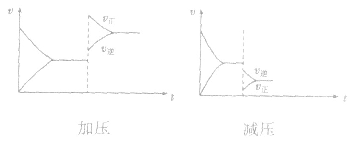
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于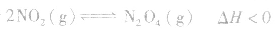 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
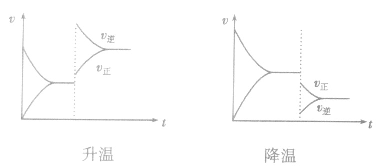
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为
稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
2.恒温恒压时
充入稀有气体 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。
3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了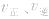 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
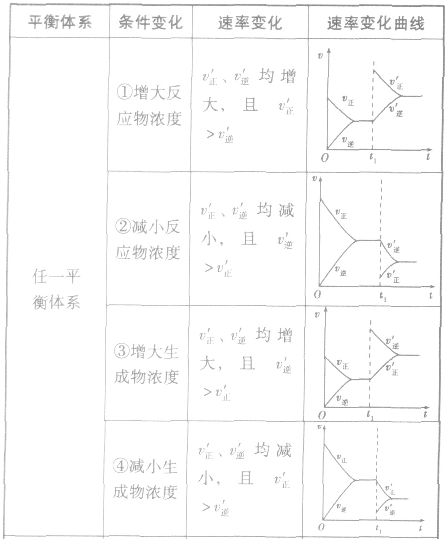
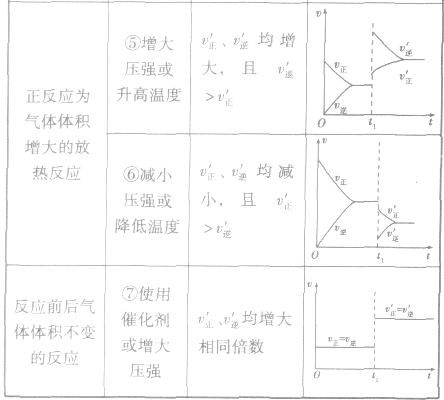
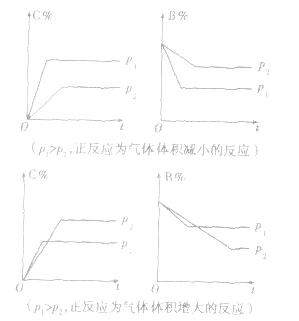
2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。

3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:
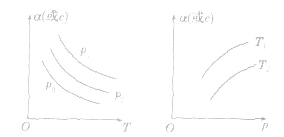
小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g) bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:

(2)若反应物不止一种时,如aA(g)+bB(g) cC(g)+dD(g):
cC(g)+dD(g):
a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如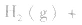
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,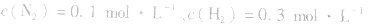 ,
,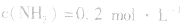 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让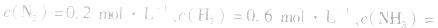
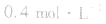 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如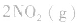
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物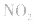 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应
 来说,加压,
来说,加压,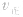 增大、
增大、 增大,
增大,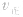 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,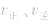 均减小,
均减小,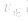 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于
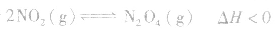 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为

稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体
 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。 2.恒温恒压时
充入稀有气体
 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了
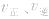 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。

2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。


3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:

小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g)
 bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
(2)若反应物不止一种时,如aA(g)+bB(g)
 cC(g)+dD(g):
cC(g)+dD(g): a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如
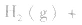
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。 4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,
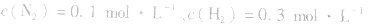 ,
,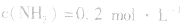 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让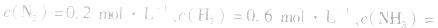
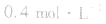 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。 5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如
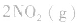
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物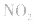 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小 发现相似题
与“在一定条件下,发生如下反应:;(1)该反应中的含义是(填序...”考查相似的试题有:
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:CH3OH(g) + H2O(g) → CO2(g) + 3H2(g) – 49.0 kJ下列说法...
- 常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ....
- 下列热化学方程式错误的是(注:△H的绝对值均正确)[ ]A.C2H5OH(l)+3O2(g)= 2CO2(g) +3H2O(g);△H= +1367.0 kJ/mol(燃烧热...
- 称取三份锌粉,分别盛于甲、乙、丙三支试管中 。甲加入50mLpH=3的盐酸,乙加入50mLpH=3的醋酸,丙加入50mLpH=3的醋酸及少量的...
- 下列说法合理的是( )A.增加反应物的用量,化学反应速率一定加快B.在等浓度NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出Ag...
- 下列条件一定能使化学反应速率增大的是①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物A.只有②B.只有②③C...
- 下列有关化学反应速率的说法中,正确的是A.铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率B.等...
- 少量铁粉与100ml 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的[ ]①加H2...
- 100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是A.加入适量的6 m...
- 反应A2+B22AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况;c为300℃时,从t3时刻开始向容器中加压的...