本试题 “电解KOH溶液时,若阴、阳两极分别为碳和铁,当生成0.1mol Fe(OH)3沉淀时,共消耗amol H2O,产生bLH2(标准状况),则a和b分别为[ ]A.a=0.25,b=2.24;B.a=...” 主要考查您对电化学有关的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电化学有关的计算
电化学计算的基本方法和技巧:
原电池和电解池的计算包括两极产物的定量计算、溶液的pH计算、相对原子质量的计算,根据电量求产物的量或根据产物的量求电量等。通常有下列三种方法。
1.根据电子守恒法
计算用于串联电路中阴、阳两极产物或正、负两极产物的量的计算,其依据是电路中转移的电子数相等。
2.根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
3.根据关系式计算
运用得失电子守恒建立已知量与未知量之间的关系式。如以通过4mole一为桥梁可构建电极产物之间的如下关系式: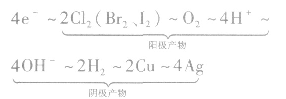
该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用这个关系式便能快速解答常见的电化学计算问题。
特别提醒:在电化学计算中,还常利用 和
和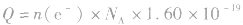 来计算电路中通过的电量。
来计算电路中通过的电量。
发现相似题
与“电解KOH溶液时,若阴、阳两极分别为碳和铁,当生成0.1mol Fe(...”考查相似的试题有:
- 一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是[ ]A.检...
- 下列说法正确的是[ ]A.1molCl2与足量Fe反应,转移电子的物质的量为2molB.工业火法炼铜:Cu2S+O2=2Cu+SO2每生成2mol铜,反应...
- A、B、C、D、E五种短周期元素,已知:①原子半径递增顺序为:A、D、C、B、E②短周期(除稀有气体元素外)所有元素中A的原子半径与...
- 1 L由K2SO4和CuSO4组成的混合溶液中c(SO42-)为2 mol·L-1,用石墨作电极电解此溶液,通电一段时间后,两极均收集到22.4 L(标...
- 在25℃时,用石墨电极电解1.0L 2.5mol/LCuSO4溶液。5min后,在一个石墨电极上有3.2g Cu生成。试回答下列问题:(1)_______...
- 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)CH3OH(g)。 分析该反应...
- 如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F 极附近显红色。试回答以下问题:(1)电...
- 如图所示为相互串联的甲、乙两个电解池,试回答:(1)若甲池利用电解原理在铁上镀银,则A极的电极材料为__________,应选用...
- 将含有0.4 mol CuSO4和0.2 mol KCl的水溶液1 L,用惰性电极电解一段时间后,在一个电极上析出19.2 g Cu,此时在另一电极上放...
- 据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下...