本试题 “海洋约占地球表面积的71%,具有十分巨大的开发潜力。某校研究性学习小组同学对经初步净化处理的浓缩海水(主要含NaCl和MgSO4)进行研究。(1)实验时若配制1000...” 主要考查您对物质的量的有关计算
电化学有关的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的量的有关计算
- 电化学有关的计算
计算物质的量浓度时应注意的问题:
物质的量浓度是表示溶液组成的一个重要物理量,是高中化学的重要内容之一。应用时要注意以下几方面的问题:
1.注意溶质是什么
对有些特殊情况要注意辨别,不能出错。如SO2、CuSO4·5H2O等溶于水后所得溶液中的溶质分别为 H2SO4和CuSO4,进行有关氨水的浓度计算时以NH3 为溶质来计算等。
2.注意溶液的体积
主要注意两点:一是不能用水的体积代替溶液的体积;二是当题设未给溶液密度时,可将各溶液(一般为稀溶液)的体积相加(如溶液混合、稀释),认为其和为溶液的总体积;当给出密度时,则需通过密度求溶液的最终体积。
3.注意单位运算
在概念理解及应用中,要注意各物理量的单位.一是各物理量的单位要相互匹配,二是从单位运算人手.能简化解题思路,快速求解。
4.注意溶解度的影响
第一,物质的量浓度适用于表示不饱和及饱和溶液中溶质与溶剂的关系,不适用于过饱和溶液(溶质未溶解完全);
第二,注意一些典型问题,如Ca(OH)2的溶解度随温度变化情况及气体物质在溶剂中的溶解问题等。
5.注意密度变化规律
在溶液混合和溶液稀释等问题中,在注意溶液体积变化的同时,还要考虑溶液密度的变化对溶质物质的量浓度的影响。如强酸、强碱、盐等溶液的密度随浓度增大而增大;氨水、乙醇等溶液的密度随浓度增大而减小。
6.注意实验情景
在计算溶液配制或溶液稀释等问题中物质的量浓度时,一要注意不能把水的体积当作溶液的体积;二是配制溶液时,要注意容量瓶规格与所需溶液体积的关系。因容量瓶的规格是固定的,所以选用的容量瓶的规格要等于或略大于所需溶液的体积。
7.注意物质与其组成粒子的关系
物质与其组成粒子的物质的量、物质的量浓度之间的关系可以通过电离方程式进行分析。如Na2SO4 溶液中c(Na+)=2c(SO42-)=2c(Na2SO4)。
以物质的量为核心的演绎公式:
1.溶液稀释定律
(1)对于已知质量分数溶液的稀释:稀释前后溶质的质量不变,即: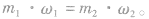
(2)对于已知物质的量浓度溶液的稀释:稀释前后溶质的物质的量不变,即: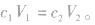
2.物质的量浓度与溶质质量分数的换算
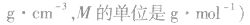
3.溶解度S与溶质质量分数ω的换算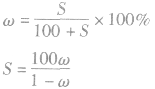
4.溶解度与饱和溶液物质的量浓度的换算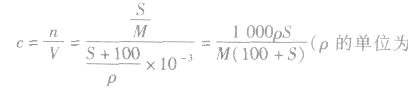

5.标准状况下气体溶于水后所得溶液的物质的量浓度的计算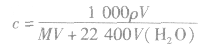
式中V为标准状况下气体的体积(L),V(H2O)为水的体积(L),ρ为溶液的密度(g·cm-3)。
6.相对密度(D)的计算及意义两种气体在同温同压下的密度之比即为相对密度,显然,它等于相对分子质量(或摩尔质量)之比,即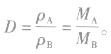
电化学计算的基本方法和技巧:
原电池和电解池的计算包括两极产物的定量计算、溶液的pH计算、相对原子质量的计算,根据电量求产物的量或根据产物的量求电量等。通常有下列三种方法。
1.根据电子守恒法
计算用于串联电路中阴、阳两极产物或正、负两极产物的量的计算,其依据是电路中转移的电子数相等。
2.根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
3.根据关系式计算
运用得失电子守恒建立已知量与未知量之间的关系式。如以通过4mole一为桥梁可构建电极产物之间的如下关系式: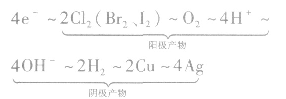
该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用这个关系式便能快速解答常见的电化学计算问题。
特别提醒:在电化学计算中,还常利用 和
和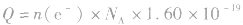 来计算电路中通过的电量。
来计算电路中通过的电量。
与“海洋约占地球表面积的71%,具有十分巨大的开发潜力。某校研究...”考查相似的试题有:
- 已知某植物营养液的配方含0.3molKCl、0.2molK2SO4、0.1molZnSO4和1LH2O.若以KCl、K2SO4、ZnCl2和1LH2O为原料配得相同组成的...
- 标况下,34g CO和CO2混合气体的体积为22.4L,关于该混合气体有下列的说法 ①混合气体中两种气体的分子个数比为5:3 ②混合气体...
- 某气体的分子组成是RO2,在标准状况下,1.28 g这种气体的体积是448 mL。求此气体的摩尔质量和R的相对原子质量。
- 实验室有甲、乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是Na2CO3溶液,为确定甲、乙的成分及其物质的量浓度,现操作...
- 某晶体的相对分子质量为250,取该晶体12.5g加热,使其失去全部结晶水后,称其质量为8g,则该晶体中结晶水的个数为( )A.2B...
- 2.2g某化合物中含有3.01×1022个甲分子,则甲的相对分子质量为( )A.44g/molB.22g/molC.44D.22
- (1)阿伏加德罗常数为NAmol-1.现有某气体,它的摩尔质量是M g•mol-1,在t℃1.01×105Pa时,气体摩尔体积为VmL•mol-1.取t℃1.0...
- 下列金属或氧化物可以完全溶解的是[ ]A.1 mol Zn与含1mol HCl 的稀盐酸共热B.1 mol Cu与含2 mol H2SO4的浓硫酸共热C.1 mol...
- 实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb+SO42-=PbSO4+2e-正极PbO2+4H++SO...
- 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,...