本试题 “下列离子方程式书写正确的是[ ]A.Na2S溶液的水解:S2-+ 2H2OH2S + 2OH-B.碳酸溶液的电离:H2CO3CO32-+ 2H+C.NH4Cl溶液的水解:NH4++ H2ONH3·H2O + H+D.Na...” 主要考查您对电离方程式
水解方程式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电离方程式
- 水解方程式
定义:
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“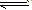 ” 。
” 。
.
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“
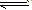 ” 。
” 。.
电离方程式的书写:
1.强电解质的电离用“ ”,弱电解质的电离用 “
”,弱电解质的电离用 “ ”。
”。
2.多元弱酸分步电离,分步持写电离方程式,一般只写第一步;多元弱碱也是分步电离的,但可按一步完全电离写出。例如:
氧硫酸: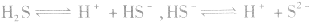
氢氧化铁:
3.强酸的酸式盐完全电离,弱酸的酸式盐中酸式酸根不完全电离。例如: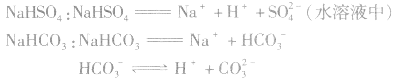
说明:在熔融状态时,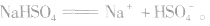
4.某些复盐能完全电离。例如:
水解方程式:
1、定义:表示盐水解的式子。
2、书写水解方程式的注意事项:
(1)找出盐类组成中会发生水解的离子(弱酸阴离子或弱碱阳离子),直接写出盐类水解的离子方程式。
(2)盐类的水解反应是中和反应的逆反应,中和反应的程度很大,水解反应的程度很小,故写盐类的水解反应方程式或离子方程式时,一般不写“=”而写“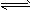 ”。
”。
(3)一般盐类水解的程度很小,水解产物也少,通常不生成沉淀或气体,也不发生分解。在书写盐类水解的离子方程式时一般不标“↑”或“↓”,也不把生成物(如NH3·H2O、H2CO3)写成其分解产物的形式。
(4)多元弱酸的盐中弱酸根离子分步水解,第一步比较容易发生,第二步比第一步难。水解时以第一步为主。多元弱酸的水解反应式应分步书写,而多元弱碱的水解反应不分步书写。
(5)某些盐溶液在混合时,由于一种盐的阳离子和另一种盐的阴离子都能发生水解,水解后溶液的性质相反,它们在一起时就能相互促进对方的水解,使两种离子的水解趋于完全。称为双水解。如:铝盐和碳酸盐混合:
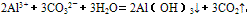 ,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。
,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。
1、定义:表示盐水解的式子。
2、书写水解方程式的注意事项:
(1)找出盐类组成中会发生水解的离子(弱酸阴离子或弱碱阳离子),直接写出盐类水解的离子方程式。
(2)盐类的水解反应是中和反应的逆反应,中和反应的程度很大,水解反应的程度很小,故写盐类的水解反应方程式或离子方程式时,一般不写“=”而写“
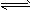 ”。
”。 (3)一般盐类水解的程度很小,水解产物也少,通常不生成沉淀或气体,也不发生分解。在书写盐类水解的离子方程式时一般不标“↑”或“↓”,也不把生成物(如NH3·H2O、H2CO3)写成其分解产物的形式。
(4)多元弱酸的盐中弱酸根离子分步水解,第一步比较容易发生,第二步比第一步难。水解时以第一步为主。多元弱酸的水解反应式应分步书写,而多元弱碱的水解反应不分步书写。
(5)某些盐溶液在混合时,由于一种盐的阳离子和另一种盐的阴离子都能发生水解,水解后溶液的性质相反,它们在一起时就能相互促进对方的水解,使两种离子的水解趋于完全。称为双水解。如:铝盐和碳酸盐混合:
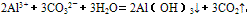 ,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。
,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。盐类水解方程式的书写:
一般来说,盐类水解的程度不大,应该用可逆号“ ”表示,盐类水解一般不会产生沉淀和气体,所以不用“↑”“↓”符号表示。
”表示,盐类水解一般不会产生沉淀和气体,所以不用“↑”“↓”符号表示。
1.一元弱酸的强碱盐和一元弱碱的强酸盐的水解。 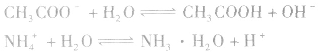
2.多元弱酸的强碱盐的水解是分步进行的,不能合并,以第一步为主。 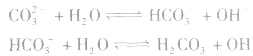
3.多元弱碱的强酸盐的水解。 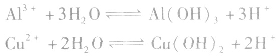
4.弱酸的铵盐的水解。 
5.完全双水解的离子间的反应用“==”表示,标明“↑”“↓”符号。如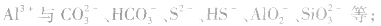


发现相似题
与“下列离子方程式书写正确的是[ ]A.Na2S溶液的水解:S2-+ 2H2O...”考查相似的试题有:
- 根据方程式:Ba(OH)2+(NH4)2SO4 △ . BaSO4↓+2NH3↑+2H2O,请回答:(1)(NH4)2SO4属于______,H2O属于______.(填字母...
- 现有等浓度的下列溶液:①CH3COOH ②HCl ③Na2CO3 ④NaHCO3 ⑤FeCl3 按溶液pH由小到大排列正确的是A.①②⑤④③B.②①⑤④③C.⑤②①④③D.①④③②⑤
- 在一定条件下,科学家利用烟道气中分离出的CO2与太阳能电解水产生的H2合成甲醇,合成过程如下图所示,已知CH3OH和H2的燃烧热...
- 下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是( )A.Na2SO4B.CH3COONaC.NH4ClD.HClO
- 欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO)、c(HCO3¯)都减少,其方法是( )A.加入氢氧化钠固体B.加水C.通入二氧化碳...
- 0.1 mol/L K2CO3溶液中,若要使c(CO32-)更接近0.1 mol/L,可采取的措施是A.加入少量盐酸B.加KOH固体C.加水D.加热
- 现有1.0 mol/L的NaOH溶液0.1L,若通入标准状况下体积为2.24L 的SO2气体,使其充分反应后,则所得溶液中各粒子浓度大小关系正...
- 有关①100ml 0.1 mol/L、②100ml 0.1 mol/L两溶液叙述不正确的是A.溶液中水电离出的个数:②>①B.溶液中阴离子的物质的量浓度之...
- 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液:(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程...
- 某漂白粉的成分为次氯酸钙和氯化钙(由氯气与石灰水恰好反应制得),其溶液中离子浓度大小关系正确的是A.c(Cl-)>c(Ca2+)>c(ClO...