本试题 “下图为冰晶体的结构模型,大球代表O原子,小球代表H原子。下列有关说法正确的是[ ]A.冰晶体中每个水分子与另外四个水分子形成四面体B.冰晶体具有空间网状结...” 主要考查您对原子晶体
分子晶体
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子晶体
- 分子晶体
相邻原子间以共价键相结合而形成空间网状结构的晶体,熔沸点高,导热性、延展性不良,导电性差,硬度大。如:金刚石、石英。
晶体的基本类型与性质:
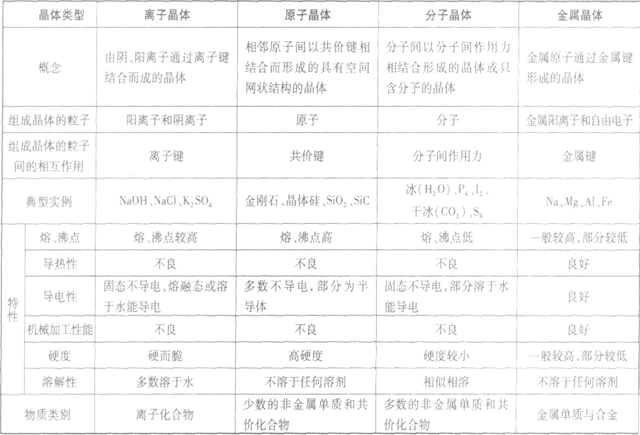
晶体熔、沸点高低的比较规律:
(1)不同类型晶体的熔、沸点高低规律:一般,原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点有的很高,如钨、铂等;有的则很低,如汞、铯等。
(2)同种类型晶体,晶体内粒子间的作用力越大,熔、沸点越高。
①分子晶体:分子间作用力越大,物质的熔、沸点越高,反之越低。
a.组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。如沸点:O2>N2、HI>HBI>HCl(含氢键的除外)。
b.相对分子质量相等或相近的分子,极性分子的范德华力大,熔、沸点高。如沸点:CO>N2。
c.含有氢键的分子熔、沸点比较高。如沸点:H2O >H2Te>H2Se>H2S,HF>HCl,NH3>PH3。
d.在烷烃的同分异构体中,一般来说,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物苯环上的同分异构体熔、沸点大小一般按照“邻位>问位>对位”的顺序。
e.在高级脂肪酸形成的油脂中,油的熔、沸点比脂肪低,烃基部分的不饱和程度越大(碳碳双键越多),熔、沸点越低,如:
(C17H35COO)3C3H5>(C17H33COO)3C3H5
硬脂酸甘油酯 油酸甘油酯
②原子晶体:要比较共价键的强弱。一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.如熔点:金刚石(C—C)>金刚砂 (Si—C)>晶体硅(Si—Si)>锗(Ge—Ge)。
③离子晶体:要比较离子键的强弱。一般来说,阴、阳离子电荷数越多,离子半径越小,离子键越强,熔、沸点越高,如熔点:MgO>NaCl,KF>KCl>KBr> KI。离子晶体的晶格能越大,其熔、沸点越高。
④金属晶体:要比较金属键的强弱。金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子间的静电作用越强,金属键越强,熔、沸点越高,反之越低,如熔点:Na<Mg<Al。
(3)元素周期表中ⅦA族卤素的单质(分子晶体) 的熔、沸点随原子序数递增而升高;笫IA族碱金属元素的单质(金属晶体)的熔、沸点随原子序数的递增而降低。如熔、沸点:Li>Na>K>Rb>Cs。
注意:上述总结的是一般规律,不能绝对化。在具体比较晶体的熔、沸点高低时,应先弄清晶体的类型,然后根据不同类型晶体进行判断,但应注意具体问题具体分析。如MgO为离子晶体,[大]为离子半径小且离子电荷多,离子键较强,其熔点(2852℃)要高于部分原子晶体,如SiO2(1710℃)。
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
晶体的基本类型与性质:

晶体结构模型:
| 晶体 | 晶体结构模型 |
| 氯化铯晶体 |  |
| 氯化钠晶体 | 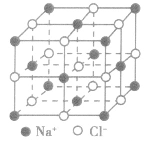 |
| 氟化钙晶体 |  |
| 二氧化碳晶体 | 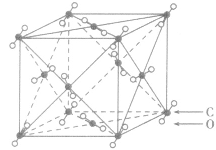 |
| 金刚石晶体 |  |
| SiO2晶体 | 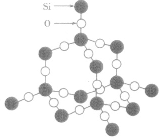 |
| 石墨晶体 (混合晶体) | 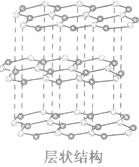 |
晶体中的几个不一定:
(1)由非金属元素构成的晶体不一定为分子品体。如NH4Cl。
(2)具有导电性的晶体不一定是金属晶体。如Si、石墨。
(3)离子晶体不一定只含离子键。如NaOH、 FeS2、Na2O2。
(4)由氢化物构成的晶体不一定是分子晶体。如NaH。
(5)金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。
(6)原子晶体不一定为绝缘体。如Si。
(7)溶于水能导电的晶体不一定是离子晶体。如HCl。
(8)离子晶体的熔点不一定低于原子晶体。如 MgO的熔点为2852℃,而SiO2的熔点为1710℃。
(9)金属晶体的熔点不一定低于原子晶体。如w 的熔点达34lO℃。
(10)金属晶体的熔点不一定高于分子晶体。如 Hg常温下呈液态,而硫、白磷常温下呈同态.
(11)金属晶体的硬度不一定小于原子晶体。如Cr 的硬度为9,仅次于金刚石。
(12)金属晶体的硬度不一定大于分子晶体。如 Na的硬度只有0.4,可用小刀切割。
(13)晶体巾有阳离子不一定有阴离子。如构成金
与“下图为冰晶体的结构模型,大球代表O原子,小球代表H原子。下...”考查相似的试题有:
- 下表是某些原子晶体的熔点和硬度分析表中的数据,判断下列叙述正确的是[ ]A.构成原子晶体的原子种类越多,晶体的熔点越高B....
- 最近,美国LawrenceLiremore国家实验室(LLNL)的V.LotA.CSYoo和Cynn成功的在40GPa的高压下,用激光器加热到1800K,将CO2转化...
- 下表给出几种氯化物的熔沸点,对此有下列说法:①CaCl2属于离子晶体②SiCl4是分子晶体③NaCl熔融可导电④MgCl2水溶液不能导电 NaC...
- (15分)可以由下列反应合成三聚氰胺:CaO+3CCaC2+CO↑,CaC2+N2CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生...
- 高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。下图所示为超氧化钾晶体的一个晶胞,则下列说法...
- 下列叙述正确的是( )A.离子晶体都是化合物B.原子晶体都是单质C.晶体内都存在化学键D.晶体内都存在分子间作用力
- 如下图所示:晶体中每个阳离子A或阴离子B均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为A.ABB.A2BC.AB2D.A2B3
- Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同...
- 二氧化硅晶体是立体的网状结构,其晶体模型如图所示。认真观察晶体模型并回答下列问题(1) 二氧化硅是一种________晶体。(2) ...
- 核能已成为当今世界的主要能源。(1)核原料UO2可通过三碳酸铀酰铵(NH4)4[UO2(CO3)3]直接煅烧还原制得。UO2晶体属CaF2型面心立...