本试题 “已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2) =1. 46×10-10。现向1L 0.2mol·L-1HF溶液中加入1L0.2mol·L-1CaCl2溶液,则下列说法中正确的是[ ]A...” 主要考查您对电离平衡常数
溶度积常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电离平衡常数
- 溶度积常数
电离平衡常数:
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用 表示,碱用
表示,碱用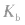 表示)。
表示)。
2.表示方法: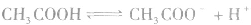
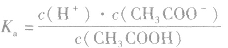
对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用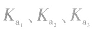 ,等分别表示,且
,等分别表示,且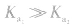
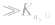
例如: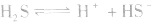
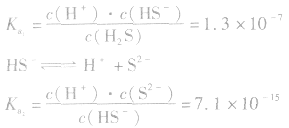
3.影响因素:温度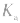 (或
(或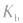 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下, 越大(多元弱酸以
越大(多元弱酸以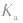 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用
 表示,碱用
表示,碱用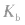 表示)。
表示)。 2.表示方法:
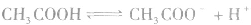
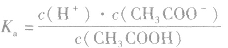
对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用
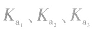 ,等分别表示,且
,等分别表示,且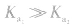
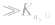
例如:
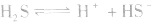
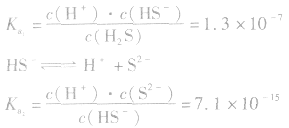
3.影响因素:温度
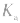 (或
(或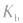 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下,
 越大(多元弱酸以
越大(多元弱酸以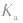 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。溶度积常数:
在AgCl(s)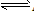 Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示
Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示
(1)溶度积的通式: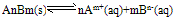 ,
,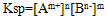
(2)溶度积规律:
①离子积: ,
,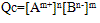
Qc为离子积,表达式中离子浓度是任意的,为此瞬间溶液的实际浓度,其值不确定,但对一难溶电解质,在一定温度下,Ksp为一定值。
②溶度积规则:
A. 当Qc>Ksp时,沉淀从溶液中析出来,体系不断析出沉淀,直至达到平衡(此时Qc=Ksp)
B. 当Qc=Ksp时,沉淀于饱和溶液平衡
C. 当Qc<Ksp时,溶液不饱和,若体系中有沉淀,则沉淀会溶解直至平衡(此时Qc=Ksp)。
在AgCl(s)
 Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示
Ag+(aq)+Cl-(aq)中,当溶解速率与结晶速率相等时,达到平衡状态,Ksp(AgCl)=[ Ag+][ Cl-]为一常数,该常数称为难难溶电解质的溶度积常数,简称溶度积。用Ksp表示(1)溶度积的通式:
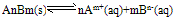 ,
,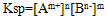
(2)溶度积规律:
①离子积:
 ,
,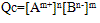
Qc为离子积,表达式中离子浓度是任意的,为此瞬间溶液的实际浓度,其值不确定,但对一难溶电解质,在一定温度下,Ksp为一定值。
②溶度积规则:
A. 当Qc>Ksp时,沉淀从溶液中析出来,体系不断析出沉淀,直至达到平衡(此时Qc=Ksp)
B. 当Qc=Ksp时,沉淀于饱和溶液平衡
C. 当Qc<Ksp时,溶液不饱和,若体系中有沉淀,则沉淀会溶解直至平衡(此时Qc=Ksp)。
发现相似题
与“已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2) =...”考查相似的试题有:
- 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HAH++A-,则K=。式中:K为电离平衡常数,...
- 已知25℃时有关弱酸的电离平衡常数则下列有关说法正确的是[ ]A.等物质的量浓度的各溶液pH关系为:B.溶液与溶液等体积混合后...
- (1)常温下有浓度均为0.5mol·L-1的四种溶液:①碳酸钠溶液;②碳酸氢钠溶液;③盐酸;④氨水。请根据题目要求回答下列问题。①上述...
- 下列说法正确的是[ ]A.电离平衡常数受溶液浓度的影响B.电离平衡常数可以表示弱电解质的相对强弱C.电离常数大的酸溶液中c(H...
- 已知:①25℃时弱电解质电离平衡常数:Ka(CH3COOH) =1.8×10-5,Ka(HSCN) =0.13;难溶电解质的溶度积常数:Ksp(CaF2) =1. 5×10-1...
- 下列说法正确的是[ ]A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数B.AgCl的Ksp=1.8×10-10mol2·L-2,在任何含A...
- 下列化学实验事实及其解释都正确的是[ ]A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明CCl4可用从碘水中萃取碘B...
- 在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的是[ ]A.Mg(OH...
- 已知CuSO4溶液分别与Na2CO3、Na2S溶液的反应情况如下: 据此判断,下列几种物质KSP大小的比较中正确的是[ ]A.Cu(OH)2<CuS...
- 已知25℃时,电离常数Ka(HF)=3.6×10-4mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10mol3·L-3。现向1L 0.2 mol·L-1HF溶液中...