本试题 “研究物质的性质和变化是认识物质的重要手段。请根据反应事实写出下列反应的化学方程式,并回答有关问题。(1)细铁丝在氧气中燃烧_______________________;...” 主要考查您对化学反应方程式的书写
溶液的定义、组成及特征
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式的书写
- 溶液的定义、组成及特征
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
溶液的概念:
一种或几种物质分散到另一种物质中,形成均一的,稳定的混合物,叫做溶液
溶液的组成:
(1)溶液由溶剂和溶质组成溶质:被溶解的物质溶剂:
溶液质量=溶剂质量+溶质质量
溶液的体积≠溶质的体积+溶剂的体积
(2)溶质可以是固体(氯化钠、硝酸钾等)、液体(酒精、硫酸等)或气体(氯化氢、二氧化碳等),一种溶液中的溶质可以是一种或多种物质。水是最常用的溶剂,汽油、洒精等也可以作为溶剂,如汽油能够溶解油脂,洒精能够溶解碘等。
溶液的特征:
均一性:溶液中各部分的性质都一样;
稳定性:外界条件不变时,溶液长时间放置不会分层,也不会析出固体溶质
对溶液概念的理解:
溶液是一种或儿种物质分散到另一种物质里.形成的均一、稳定的混合物。应从以下几个方面理解:
(1)溶液属于混合物;
(2)溶液的特征是均一、稳定;
(3)溶液中的溶质可以同时有多种;
(4)溶液并不一定都是无色的,如CuSO4溶液为蓝色;
(5)均一、稳定的液体并不一定郡是溶液,如水;
(6)溶液不一定都是液态的,如空气。
溶液与液体
(1)溶液并不仅局限于液态,只要是分散质高度分散(以单个分子、原子或离子状态存在)的体系均称为溶液。如锡、铅的合金焊锡,有色玻璃等称为固态溶液。气态的混合物可称为气态溶液,如空气。我们通常指的溶液是最熟悉的液态溶液,如糖水、盐水等。
(2)液体是指物质的形态之一。如通常状况下水是液体,液体不一定是溶液。
3. 溶液中溶质、溶剂的判断
(1)根据名称。溶液的名称一般为溶质的名称后加溶剂,即溶质在前,溶剂在后。如食盐水中食盐是溶质,水是溶剂,碘酒中碘是溶质,酒精是溶剂。
(2)若是固体或气体与液体相互溶解成为溶液。一般习惯将固体或气体看作溶质,液体看作溶剂。
(3)若是由两种液体组成的溶液,一般习惯上把量最多的看作溶剂,量少的看作溶质。
(4)其他物质溶解于水形成溶液时。无论,水量的多少,水都是溶剂。
(5)一般水溶液中不指明溶剂,如硫酸铜溶液,就是硫酸铜的水溶液,蔗糖溶液就是蔗糖的水溶液,所以未指明溶剂的一般为水。
(6)物质在溶解时发生了化学变化,那么在形成的溶液中,溶质是反应后分散在溶液中的生成物。如 Na2O,SO3分别溶于水后发生化学反应,生成物是 NaOH和H2SO4,因此溶质是NaOH和H2SO4,而不是 Na2O和SO3;将足量锌粒溶于稀硫酸中所得到的溶液中,溶质是硫酸锌(ZnSO4),若将蓝矾(CuSO4·5H2O) 溶于水,溶质是硫酸铜(CuSO4),而不是蓝矾。
溶液的导电性:
探究溶液导电性的实验:
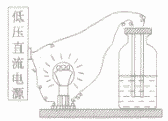
用如图所示的装置试验一些物质的导电性。可以养到蒸馏水、乙醉不导电,而盆酸、硫酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、碳酸钠溶液均能导电。
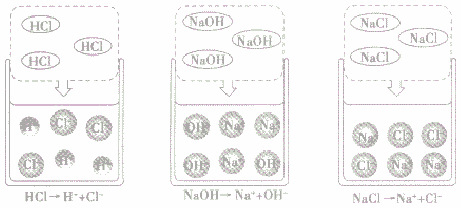
酸、碱、盐溶液导电的原因:
酸、碱、盐溶于水,在水分子作用下,电离成自由移动的带正(或负)电的阳(或阴)离子(如下图所示)。因此酸、碱、盐的水溶液都能导电,导电的原因是溶液中存在自由移动的离子,而蒸馏水和乙醇中不存在自由移动的离子。
发现相似题
与“研究物质的性质和变化是认识物质的重要手段。请根据反应事实...”考查相似的试题有:
- 以下化学用语与含义相符的是( )A.2N :两个氮分子B.:氧化镁中镁元素的化合价为+2价C.He:一个氦元素D.CO2:一个二氧化...
- 下列化学方程式书写正确的是
- 镁条在空气中燃烧,不仅生成氧化镁,还有少量镁与氮气化合生成氮化镁(Mg3N2).(1)氮化镁中氮元素的化合价为______;(2)...
- 一定条件下,仅由氯化钠的水溶液肯定不能制得的是A.NaOHB.H2C.HClD.Na2SO4
- 完成下列文字表达式,从反应条件、产物以及反应类型比较它们的异同点.(1)木炭在氧气中燃烧______:(2)硫在氧气中燃烧___...
- (每空2分,共4分)氢气在氯气中燃烧生成氯化氢,反应的微观过程如图所示:(1)写出该反应的化学方程式___________________...
- 草酸钙(化学式为CaC2O4,相对分子质量为128)是一种难溶于水的白色固体,受热能分解.小红同学为了探究其在加热条件下发生的...
- 地球上的淡水资源是十分有限的.人类生产、生活造成的水体污染加剧了水资源危机.常州市的水资源十分丰富,但作为常州明珠的...
- 石英钟、电子表使用石英晶体代替传统钟表中的摆和游丝,提高了钟表计时的精确度。已知石英的主要成分是二氧化硅(SiO2),其...
- 野炊活动过程中会涉及许多化学知识的运用.某次野炊活动过程中,同学们携带了铁锅、牛肉、面条、西红柿、食用油、食盐、味精...