本试题 “下列叙述中,正确的是( ) A.甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•m...” 主要考查您对热化学方程式
熵;熵变
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 热化学方程式
- 熵;熵变
热化学方程式:
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如: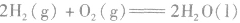 :
: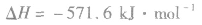 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如:
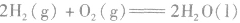 :
: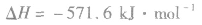 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
自发过程与自发反应:
在一定温度和压强下,无需外界帮助就能自动进行的过程叫做自发过程;在一定温度和压强下,无需外界帮助就可以自发进行到显著程度的化学反应叫自发反应。
化学反应方向的判据:
1.焓变对反应方向的影响:
△H<0 的化学反应也能自发进行。但有些△H>0的化学反应也能自发进行,也就是说,焓变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素:
2.熵与熵变:
熵是用于描述体系混乱度的物理量,以符号S表示。熵值越大,体系的混乱度越大。
在一定条件下,不同物质的熵值不同;对同一物质来说,S(g)>S(l)>S(s),S(aq)>S(s)。
物质发生化学反应后熵值也发生变化,这个熵值的变化叫做反应的熵变,以符号△S表示,单位是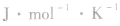 。
。
△S=生成物总熵一反应物总熵
若△S为正值,表示反应过程中熵值增大,称为熵增过程;若△S为负值,表示反应过程中熵值减小,称为熵减过程。在与外界隔离的体系中,自发过程将导致体系的熵值增大,这个原理也叫做熵增原理。
3.熵变对反应方向的影响:
△S>0有利于化学反应的自发进行,有些△S>0 的化学反应在常温下不能自发进行,但在较高温度下可以自发进行,有些△S<0的化学反应也能自发进行。总之,熵变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素。
4.焓变与熵变对反应方向的共同影响:
在温度和压强一定的条件下,化学反应的方向是反应的焓变和熵变共同影响的结果,反应方向的判据是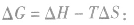
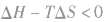 反应能自发进行
反应能自发进行
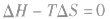 反应达到平衡状态
反应达到平衡状态
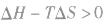 反应不能自发进行
反应不能自发进行
在一定温度和压强下,无需外界帮助就能自动进行的过程叫做自发过程;在一定温度和压强下,无需外界帮助就可以自发进行到显著程度的化学反应叫自发反应。
化学反应方向的判据:
1.焓变对反应方向的影响:
△H<0 的化学反应也能自发进行。但有些△H>0的化学反应也能自发进行,也就是说,焓变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素:
2.熵与熵变:
熵是用于描述体系混乱度的物理量,以符号S表示。熵值越大,体系的混乱度越大。
在一定条件下,不同物质的熵值不同;对同一物质来说,S(g)>S(l)>S(s),S(aq)>S(s)。
物质发生化学反应后熵值也发生变化,这个熵值的变化叫做反应的熵变,以符号△S表示,单位是
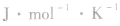 。
。△S=生成物总熵一反应物总熵
若△S为正值,表示反应过程中熵值增大,称为熵增过程;若△S为负值,表示反应过程中熵值减小,称为熵减过程。在与外界隔离的体系中,自发过程将导致体系的熵值增大,这个原理也叫做熵增原理。
3.熵变对反应方向的影响:
△S>0有利于化学反应的自发进行,有些△S>0 的化学反应在常温下不能自发进行,但在较高温度下可以自发进行,有些△S<0的化学反应也能自发进行。总之,熵变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素。
4.焓变与熵变对反应方向的共同影响:
在温度和压强一定的条件下,化学反应的方向是反应的焓变和熵变共同影响的结果,反应方向的判据是
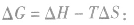
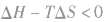 反应能自发进行
反应能自发进行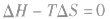 反应达到平衡状态
反应达到平衡状态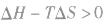 反应不能自发进行
反应不能自发进行 发现相似题
与“下列叙述中,正确的是( ) A.甲烷的标准燃烧热为890.3 kJ•m...”考查相似的试题有:
- 碳、氮元素及其化合物与人类的生产生活密切相关.试回答下列有关问题:(1)下图是1molNO2和1molCO反应生成CO2和NO过程中能量...
- 下列热化学方程式或离子方程式正确的是( )A.已知H2的标准燃烧热△H=-285.8kJ•mol-1,则用热化学方程式可表示为:H2(g)+1/...
- 甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。(1 )甲硅烷中含有的化学键是_________ ,其在固态时属于______ ...
- 家用液化气中主要成分之一是丁烷。在101kPa时,10kg丁烷完全燃烧生成CO2和H2O放出热量5×105kJ,丁烷的燃烧热为_________,丁...
- 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是[ ]A.CH3OH(l)+ 3/2O2(g)==CO2(g)+2H...
- 根据以下3个热化学方程式,下列有关Q1、Q2、Q3三者关系的判断中正确的是2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=―Q1 kJ/mol2H2S...
- 1.00L 1.00mol·L-1H2SO4溶液与2.00L 1.00mol·L-1NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,...
- 化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g) 生...
- 已知热化学方程式C2H2(g)+52O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是( )A.乙炔的燃烧热为1256kJ/...
- 下列关于化学反应的自发性叙述中正确的是( )A.焓变小于0而熵变大于0的反应肯定是自发的B.焓变和熵变都小于0的反应肯定是...