本试题 “金属铜可与盐酸、氧气发生反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列有关HO2的说法正确的是[ ]A.具...” 主要考查您对元素化合价的求法
共价化合物
共价键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 元素化合价的求法
- 共价化合物
- 共价键
求化合价的原则:
在化合物中,正负化合价的代数和为0。
化合价规律:
1.在单质中,元素的化合价为0。
2.在化合物中,氢常显+1价,氧显-2价。金属元素通常显正价,非金属元素显负价。在非金属氧化物中,氧显-2价,非金属元素显正价,因而非金属元素可以有正价和负价。
3.在不同的条件下,某元素可以表现出不同的化合价
4.原子团也表现化合价,其化合价数值由构成原子的正负化合价的代数和算出。
常见元素化合价口诀:
一价氢氯钾钠银,
二价氧钙钡镁锌,
三铝、四硅、五价磷,
二三铁、二四碳,二四六硫都齐全,
氢一氧二为标准,
铜汞二价最常见,
单质价数都为零。
负一氢氧硝酸根
负二硫酸碳酸根负
三记住磷酸根
正一价的是铵根
定义:
直接相邻原子间均以共价键相结合的化合物。共价化合物中只含共价键。
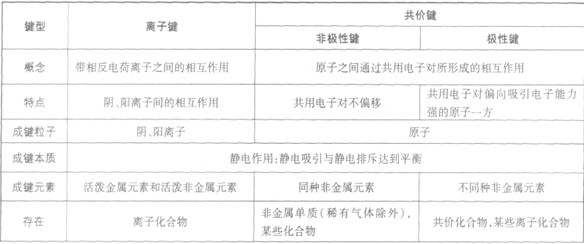
离子化合物和共价化合物的比较:

直接相邻原子间均以共价键相结合的化合物。共价化合物中只含共价键。
离子化合物和共价化合物的比较:

共价键:
1.本质原子之间形成共用电子对(或电子云重叠),使得电子出现在核间的概率增大。
2.特征
具有方向性与饱和性。
(1)共价键的饱和性一个原子中的一个未成对电子与另一个原子中的一个未成对电子配对成键后,一般来说就不能再与其他原子的未成对电子配对成键了,即每个原子所能形成共价键的总数或以单键连接的原子数目是一定的,这称为共价键的饱和性。
例如,氯原子中只有一个未成对电子,所以两个氯原子之间可以形成一个共价键,结合成氯分子,表示为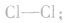 氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为
氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为 一个氮原子也可与_二个氢原子以三个共价键结合成氨分子,表示为
一个氮原子也可与_二个氢原子以三个共价键结合成氨分子,表示为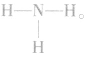
(2)共价键的方向性
共价键将尽可能沿着电子出现概率最大的方向形成,这就是共价键的方向性。除s轨道是球形对称外,其他原子轨道都具有一定的空间分布。在形成共价键时,原子轨道重叠得越多,电子在核间出现的概率越大,所形成的共价键就越牢固。
例如,硫原子的价电子排布是 有两个未成对电子,如果它们分布在互相垂直的
有两个未成对电子,如果它们分布在互相垂直的 轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢原子的1s轨道上的电子能与硫原子的
轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢原子的1s轨道上的电子能与硫原子的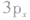 轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的
轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的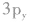 轨道上的电子配对成键。
轨道上的电子配对成键。
说明:
①共价键的饱和性决定着各种原子形成分子时相互结合的数量关系。如一个氢分子只能由两个氢原子构成,一个水分子只能由两个氢原子和一个氧原子构成。
②共价键的方向性决定着分子的空间构型。
3.分类
(1)按成键原子是否相同或共用电子对是否偏移分 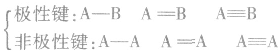
(2)按成键方式分

(3)按共用电子对数分
离子键和共价键:

发现相似题
与“金属铜可与盐酸、氧气发生反应:Cu+HCl+O2=CuCl+HO2,HO2(超...”考查相似的试题有:
- 用48 mL 0.1 mol/L的FeSO4溶液,恰好还原2.4×10-3mol[RO(OH)2]+离子,则R元素的最终价态为[ ]A.+2价B.+3价C.+4价D.+5价
- 下列物质中含有共价键的离子化合物是( )A.KOHB.NaClC.CO2D.CH4
- 共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是[ ]A.干冰B.氯化钠C.氢氧化钠...
- 据最新报道,科学家发现了如下反应:O2+PtF6===O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正...
- 目前,全世界镍(Ni)的消费量仅次于铜、铝、铅、锌,居有色金属第五位,镍行业的发展蕴藏着巨大的潜力。(1)基态Ni原子的核外电...
- 下列各组分子中化学键类型有明显差异的是[ ]A. H2O、CO2B. MgF2、H2O2C. NaOH 、Ba(OH)2D. NaCl 、KCl
- (1)用电子式表示H2O和MgBr2的形成过程____________________________________。(2)H2O以___________键结合,MgBr2以______...
- 下列叙述正确的是[ ]A.溶液和胶体的本质区别是有无丁达尔效应B.玻璃、水泥和光导纤维的主要成分都是硅酸盐C.常用危险化学...
- 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是[ ]A.SO2和SiO2B.CO2和H2OC.NaCl和HClD.Na2O2和H2O2
- 下列说法中正确的是( )A.分子中键能越大,键长越长,则分子越稳定B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间可能...