本试题 “下列说法中正确的是[ ]A.NH3、PCl5、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构B.P4和CH4都是正四面体分子且键角都为109°28′C.Na...” 主要考查您对晶胞
原子晶体
8电子稳定结构
键能、键长、键角
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 晶胞
- 原子晶体
- 8电子稳定结构
- 键能、键长、键角
晶胞:
1.定义描述晶体结构的基本单元叫做晶胞。
2.结构一般来说,晶胞为平行六面体,晶胞只是晶体微观空间里的一个基本单元,在它的上、下、左、右、前、后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。“无隙”是指相邻晶胞之间没有任何间隙,“并置”是指所有晶胞都是平行排列的,取向相同。
晶胞中微粒数目的确定:
计算晶胞中微粒数目的常用方法是均摊法。均摊法是指每个晶胞平均拥有的粒子数目。如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞。
属于这个晶胞。
(1)长方体(或正方体)形晶胞中不同位置的粒子数的计算。
①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有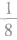 属于该晶胞。
属于该晶胞。
②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有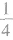 属于该晶胞。
属于该晶胞。
③处于面上的粒子,同时为2个晶胞所共有。每个粒子有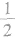 属于该晶胞。
属于该晶胞。
④处于晶胞内部的粒子,则完全属于该晶胞。
(2)非平行六面体形晶胞中粒子数目的计算同样可用均摊法,其关键仍然是确定一个粒子为几个晶胞所共有。例如,石墨晶胞每一层内碳原子排成许多个六边形,其顶点(1个碳原子)对六边形的贡献为 ,那么每一个六边形实际有6×
,那么每一个六边形实际有6× =2个碳原子。
=2个碳原子。
(3)在六棱柱晶胞(如图所示 MgB2的晶胞)中,顶点上的原子为6 个晶胞(同层3个,上层或下层3个) 共有,面上的原子为2个晶胞共有,因此镁原子个数为12×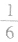 +2×
+2×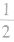 =3,硼原子个数为6。
=3,硼原子个数为6。 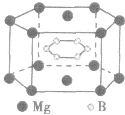
特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定式,不同形状的晶胞应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心上的原子依次被6、3、4、2 个晶胞共用。
有关晶胞密度的计算步骤:
①根据“分摊法”算出每个晶胞实际含有各类原子的个数,计算出晶胞的质量m:
②根据边长计算晶胞的体积V:
③根据 进行计算,得出结果。
进行计算,得出结果。
相邻原子间以共价键相结合而形成空间网状结构的晶体,熔沸点高,导热性、延展性不良,导电性差,硬度大。如:金刚石、石英。
晶体的基本类型与性质:
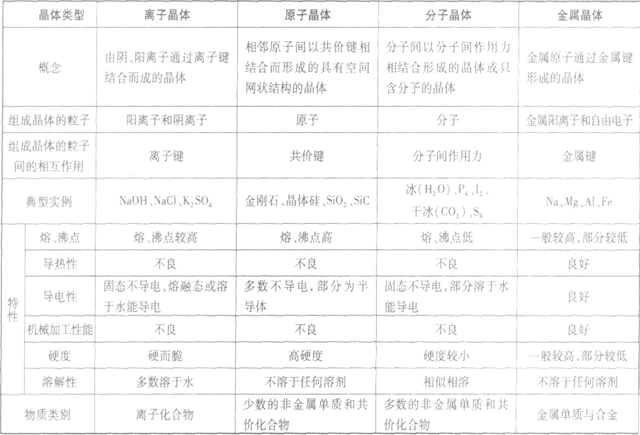
晶体熔、沸点高低的比较规律:
(1)不同类型晶体的熔、沸点高低规律:一般,原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点有的很高,如钨、铂等;有的则很低,如汞、铯等。
(2)同种类型晶体,晶体内粒子间的作用力越大,熔、沸点越高。
①分子晶体:分子间作用力越大,物质的熔、沸点越高,反之越低。
a.组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。如沸点:O2>N2、HI>HBI>HCl(含氢键的除外)。
b.相对分子质量相等或相近的分子,极性分子的范德华力大,熔、沸点高。如沸点:CO>N2。
c.含有氢键的分子熔、沸点比较高。如沸点:H2O >H2Te>H2Se>H2S,HF>HCl,NH3>PH3。
d.在烷烃的同分异构体中,一般来说,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物苯环上的同分异构体熔、沸点大小一般按照“邻位>问位>对位”的顺序。
e.在高级脂肪酸形成的油脂中,油的熔、沸点比脂肪低,烃基部分的不饱和程度越大(碳碳双键越多),熔、沸点越低,如:
(C17H35COO)3C3H5>(C17H33COO)3C3H5
硬脂酸甘油酯 油酸甘油酯
②原子晶体:要比较共价键的强弱。一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.如熔点:金刚石(C—C)>金刚砂 (Si—C)>晶体硅(Si—Si)>锗(Ge—Ge)。
③离子晶体:要比较离子键的强弱。一般来说,阴、阳离子电荷数越多,离子半径越小,离子键越强,熔、沸点越高,如熔点:MgO>NaCl,KF>KCl>KBr> KI。离子晶体的晶格能越大,其熔、沸点越高。
④金属晶体:要比较金属键的强弱。金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子间的静电作用越强,金属键越强,熔、沸点越高,反之越低,如熔点:Na<Mg<Al。
(3)元素周期表中ⅦA族卤素的单质(分子晶体) 的熔、沸点随原子序数递增而升高;笫IA族碱金属元素的单质(金属晶体)的熔、沸点随原子序数的递增而降低。如熔、沸点:Li>Na>K>Rb>Cs。
注意:上述总结的是一般规律,不能绝对化。在具体比较晶体的熔、沸点高低时,应先弄清晶体的类型,然后根据不同类型晶体进行判断,但应注意具体问题具体分析。如MgO为离子晶体,[大]为离子半径小且离子电荷多,离子键较强,其熔点(2852℃)要高于部分原子晶体,如SiO2(1710℃)。
8电子稳定结构:
每个原子最外层都有8个电子。
规律总结:
①分子中若含有氢元素,则氢原子不能满足最外层八电子稳定结构,但它满足K层为最外层两个电子的稳定结构。同样Be原子最外层只有两个电子,在其化合物中最外层电子数也不可能满足八电子的稳定结构。
②分子中若不含有氢元素,可按下述方法进行判断:若某元素的化合价的绝对值与其原子最外层电子数之和等于八,则该元素的原子最外层满足八电子的稳定结构;否则不满足。例如:CO2分子中,碳元素的化合价为+4价,碳原子最外层电子数为四,二者之和为八,则碳原子满足最外层八电子稳定结构;氧元素化合价为-2(其绝对值为2),氧原子最外层电子数为六,二者之和为八,则氧原子也满足最外层八电子的稳定结构。如NO2分子中,氮元素的化合价为+4价,氮原子最外层的电子数为五,二者之和为九,故氮原子不满足最外层八电子的稳定结构。再如BF3分子中,硼元素的化合价为+3,硼原子最外层的电子数为三,二者之和为六,故硼原子不满足最外层八电子的稳定结构。
③若为同种元素组成的双原子分子,则看该元素原子的最外层电子数目与其在分子中形成的共价键的数目之和是否为八,若为八,则其最外层满足八电子结构,反之不满足。如常见的X2(卤素单质)、O2、N2等双原子单质分子中原子最外层为八电子稳定结构。
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如,
 分子中:
分子中: X原子半径:
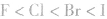
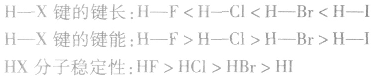
与“下列说法中正确的是[ ]A.NH3、PCl5、BF3、NCl3分子中没有一...”考查相似的试题有:
- 下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。(1)Y分别与D、E形成的化合物中熔点较高是_____________ ...
- 氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的...
- 下列说法正确的是A.原子晶体中的相邻原子都以共价键相结合B.金属晶体的熔点都比分子晶体的熔点高C.干冰升华时,分子内共价...
- 现有下列各项关于不同状态的物质属性的描述 :①构成微粒间有较小空隙,②构成微粒可以自由移动,③没有固定形状,④不易被压缩。...
- 通常人们把拆开1mol某化学键所吸收的能量看成化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(...
- 下列关于晶体的说法正确的组合是[ ]①分子晶体常温下都呈液态或气态;②在晶体中只要有阴离子就一定有阳离子;③金刚石、SiO2、N...
- 氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于A.原子晶体B.分子晶体C.金属晶体D.离子晶体
- 由下列三种元素构成的化合物中既有离子晶体,又有分子晶体的是A.H、O、C B.Na、S、O C.H、N、O D.H、S、O
- 关于晶体的自范性,下列叙述正确的是( )。A.破损的晶体能够在固态时自动变成规则的多面体B.缺角的氯化钠晶体在饱和的NaCl...
- 金属晶体的下列性质中,不能用金属晶体结构加以解释的是