本试题 “3.2g铜与过量的硝酸(8mol/L,30mL)充分反应,硝酸的还原产物是NO和NO2,反应后溶液中含有amolH+,则此时溶液中含有NO3-的物质的量为( )A.(0.1+a)molB...” 主要考查您对化学反应方程式
(浓、稀)硝酸
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式
- (浓、稀)硝酸
化学方程式:
用化学式来表示化学反应的式子,叫做化学方程式。化学方程式不仅表明了反应物、生成物和反应条件,同时,通过相对分子质量或相对原子质量还可以表示个物质之间的质量关系,即各物质之间的质量比。
书写化学方程式要遵守两个原则:
一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;
二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等。
化学方程式的意义:
化学方程式不仅表明了反应物、生成物和反应条件。同时,化学计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。
硝酸的分子结构:
化学式(分子式):HNO3,结构式:HO—NO2。 HNO3是由极性键形成的极性分子,故易溶于水,分子问以范德华力结合,固态时为分子晶体。
硝酸的物理性质和化学性质:
(1)物理性质:纯硝酸是无色油状液体, 开盖时有烟雾,挥发性酸[沸点低→易挥发→酸雾]
熔点:-42℃,沸点:83℃。密度:1.5 g/cm3,与水任意比互溶,98%的硝酸为发烟硝酸,69%以上的硝酸为浓硝酸。
(2)化学性质:
①具有酸的一些通性:例如: 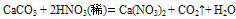 (实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)
(实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)
②不稳定性:HNO3见光或受热发生分解,HNO3越浓,越易分解.硝酸分解放出的NO2溶于其中而使硝酸呈黄色。有关反应的化学方程式为: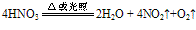
③强氧化性:不论是稀HNO3还是浓HNO3,都具有极强的氧化性,HNO3浓度越大,氧化性越强。其氧化性表现在以下几方面
A. 几乎能与所有金属(除Hg、Au外)反应。当HNO3与金属反应时,HNO3被还原的程度(即氮元素化合价降低的程度)取决于硝酸的浓度和金属单质还原性的强弱。对于同一金属单质而言,HNO3的浓度越小,HNO3被还原的程度越大,氮元素的化合价降低越多。一般反应规律为:
金属 + HNO3(浓) → 硝酸盐 + NO2↑ + H2O
金属 + HNO3(稀) → 硝酸盐 + NO↑ + H2O
较活泼的金属(如Mg、Zn等) + HNO3(极稀) → 硝酸盐 + H2O + N2O↑(或NH3等)
金属与硝酸反应的重要实例为:
①
该反应较缓慢,反应后溶液显蓝色,反应产生的无色气体遇到空气后变为红棕色(无色的NO被空气氧化为红棕色的NO2)。实验室通常用此反应制取NO气体。
②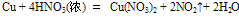
该反应较剧烈,反应过程中有红棕色气体产生。此外,随着反应的进行,硝酸的浓度渐渐变稀,反应产生的气体是NO2、NO等的混合气体。
B. 常温下,浓HNO3能将金属Fe、A1钝化,使Fe、A1的表面氧化生成一薄层致密的氧化膜。因此,可用铁或铝制容器盛放浓硝酸,但要注意密封,以防止硝酸挥发变稀后与铁、铝反应。(与浓硫酸相似)
C. 浓HNO3与浓盐酸按体积比1∶3配制而成的混合液叫王水。王水溶解金属的能力更强,能溶解金属Pt、Au。
D. 能把许多非金属单质(如C、S、P等)氧化,生成最高价含氧酸或最高价非金属氧化物。例如: 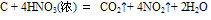
E.能氧化某些具有还原性的物质,如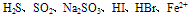 等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。
等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。
(3)保存方法:硝酸易挥发,见光或受热易分解,具有强氧化性而腐蚀橡胶,因此,实验室保存硝酸时,应将硝酸盛放在带玻璃塞的棕色试剂瓶中,并贮存在黑暗且温度较低的地方。
(4)用途:硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料、硝酸盐等。
三大强酸:
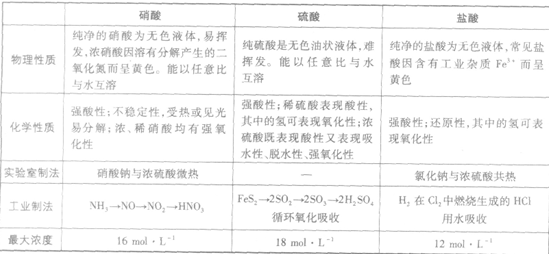
几种常见酸的比较:
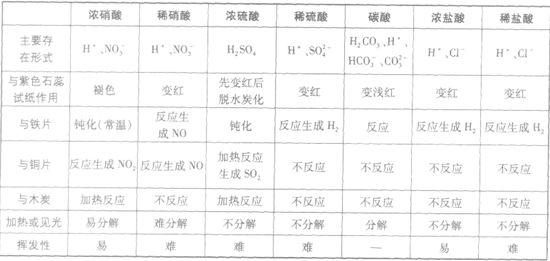
浓硝酸与稀硝酸的氧化性比较:
由铜与硝酸反应的化学方程式知,浓硝酸被还原为NO2,氮的化合价由+5→+4;而稀硝酸被还原为NO,氮的化合价由+5→+2,由此得出稀硝酸具有更强的氧化能力的结论是错误的。因为氧化剂氧化能力的强弱取决于得电子能力的强弱,而不是本身被还原的程度。实验证明,硝酸越浓,得电子的能力越强,因而其氧化能力越强。如稀硝酸能将HI氧化为I2,而浓硝酸可将HI氧化为HIO3。
硝酸在氧化还原反应中,其还原产物可能有多种价态的物质: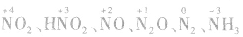 等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
浓硝酸的漂白作用:
在浓硝酸中滴入几滴紫色石蕊试液,微热,可观察到:溶液先变红后褪色,说明浓硝酸具有强氧化性,可以使某些有色物质褪色(氧化漂白)。但一般不用它作漂白剂,因为它还具有强腐蚀性。新制氯水或浓硝酸能使淀粉碘化钾试纸先变蓝后褪色,这不是因为它们的漂白性,而是因为发生了如下的化学反应: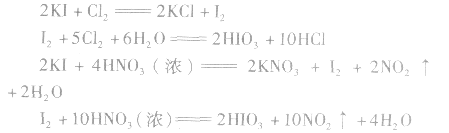
这是因为过量的氯水或硝酸又把I2氧化成了HIO3而使试纸褪色的。
另外,浓H2SO4遇湿润的蓝色石蕊试纸的现象是先变红后变黑。这是由浓H2SO4的强酸性和脱水性造成的(脱水炭化而变黑)。
与“3.2g铜与过量的硝酸(8mol/L,30mL)充分反应,硝酸的还原产...”考查相似的试题有:
- 反应A+B═C+D,8gA和12gB恰好完全反应,生成C和9gD,则生成C的质量为( )A.9gB.10gC.11gD.12g
- 将1.12L标准状况下由X、Y组成的混合气体用水全部吸收得到1L溶液,测得pH=1,则X、Y可能是( ),X与Y的体积比为( )A.H2,C...
- 下列事实与结论相符且正确的是( )A.100mL、1mol•L-1AlCl3溶液中加入400mL、1mol•L-1NaOH溶液,AlO2-数目为0.1NA(NA代表阿...
- 分别用浓度都为0.1mol/L的NaCl溶液、MgCl2溶液、AlCl3溶液与AgNO3溶液反应,产生物质的量相等的氯化银沉淀.消耗这三种溶液的...
- 使5.6L CO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况),这4.48L气体的质量为( )A.6.4gB.11gC.8.2gD.1.6g
- 500mL某浓度的NaOH溶液恰好与标准状况下的11.2L CO2完全反应生成正盐.试计算:(1)生成正盐的物质的量.(2)原溶液中NaOH...
- 对下列事实的解释错误的是( )A.氨溶于水的喷泉实验,说明氨气极易溶于水B.常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有...
- 在Fe , Cu的混合物中加入一定量的稀硝酸并微热,充分反应后剩余金属a克。再向其中加入一定量的稀盐酸并加热,充分振荡后还剩...
- 某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了下图所示的工艺流程,利用常用的酸、碱和工业生产中的...
- 每逢佳节倍思美味佳肴,食醋是一种生活必备的食品调味剂。淘气的胖胖分别向盛有下列物质的玻璃杯中倒入适量食醋,他不会观察...