本试题 “决定物质性质的重要因素是物质结构。请回答下列问题。(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示A的化合价____(填“>”“” 主要考查您对电子排布式
原子核外电子的排布
杂化轨道理论(中心原子杂化方式)
晶胞
电离能
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电子排布式
- 原子核外电子的排布
- 杂化轨道理论(中心原子杂化方式)
- 晶胞
- 电离能
电子排布式:
①简化电子排布式
为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的冗素符号外加方括号表示,即为简化电子排布式,如K 的简化电子排布式为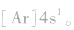
②特殊电子排布式
有个别元素的基态原子的电子排布对于构造原理有1个电子的反常。因为能量相同的原子轨道在全充满( )、半充满(
)、半充满(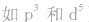 )和全空(
)和全空(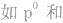
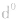 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。 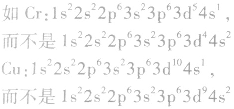
(2)电子排布图:用方框表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。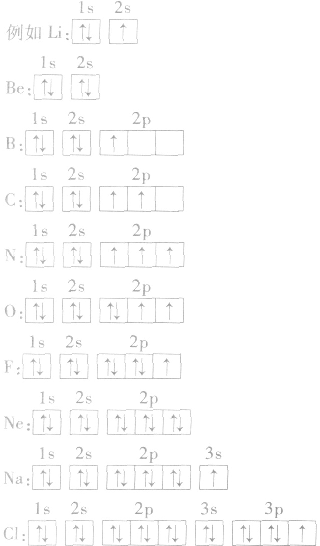
构造原理:
多电子原子的核外电子排布总是按照能量最低原理,由低能级逐步填充到高能级。绝大多数元素的原子核外电子的排布遵循下图所示的排布顺序,这种排布顺序被称为构造原理。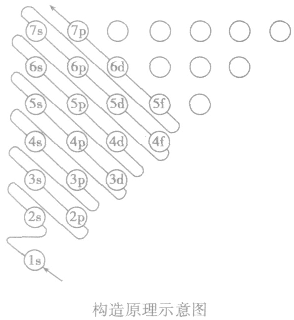
点拨:构造原理中的排布顺序,其实质是各能级的能量高低顺序,可由下列公式得出ns<(n一2)f< (n一1)d<np(n表示能层序数)。常用的重要的能级交错顺序有: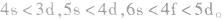
核外电子排布式一构造原理的应用:
根据构造原理,按照能级顺序,用能级符号右上角的数字表示该能级上电子数的式子,叫做电子排布式。例如,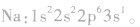
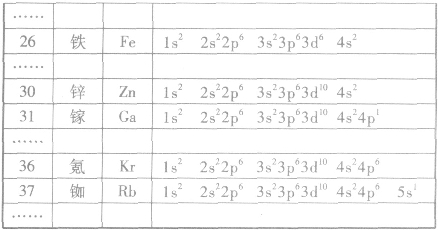
原子核外电子的排布:
在多电子原子中,由于各电子所具有的能量不同,因而分布在离核远近不同的区域内做高速运动。能量低的电子在离核近的区域内运动,能量高的电子在离核较远的区域内运动。
电子层:
电子层在含有多个电子的原子里,电子分别存能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层,分别用n=1,2,3,4,5.6,7或K、L、 M、N、O、P、Q来表示从内到外的电子层 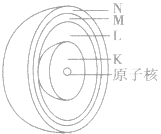

原子结构与元素的性质:
原子的核外电子排布对元素的化学性质有着非常重要的影响。元素的化学性质主要取决于原子的核外最外层电子数。
1.元素的金属性、非金属性(得失电子能力)与最外层电子数的关系
(1)稀有气体元素原子最外层电子数为8(He为 2),已达稳定结构,既不易失电子也小易得电子,所以化学性质不活泼。
(2)金属元素原子最外层电子数一般小于4,较易失去电子而达到稳定结构,其单质表现还原性。
(3)非金属元素原子最外层电子数一般大于或等于4,较易获得电子而达到稳定结构,其单质多表现氧化性。
2.元素的化合价与原子最外层电子数的关系
元素显正价还是显负价及其数值大小与原子的最外层电子数密切相关。其一般规律可归纳如下表: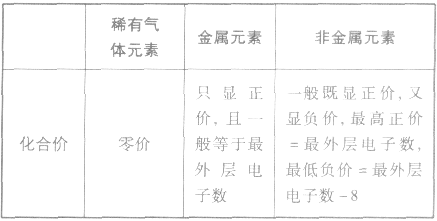
核外电子排布的一般规律:
(1)原子核外各电子层最多容纳2n2个电子.
(2)原子最外层电子数目不超过8个(K层为最外层时不超过2个)。
(3)次外层电子数目不超过18个(K层为次外层时不超过2个,L层为次外层时不超过8个)。倒数第三层电子数目不超过32个。
(4)核外电子分层排布,电子总是优先排布在能量最低的电子层里,然后由里向外,依次排布在能量逐渐升高的电子层里,即最先排K层,当K层排满后,冉排L层等。原子核外电子排布不是孤立的,而是相互联系的。层数相同而位置不同的电子层中最多容纳的电子数小一定相同,如N层为最外层时,最多只能排8个电子;N层为次外层时,最多只能排18个电子而不是32个电子(2×42=32)。
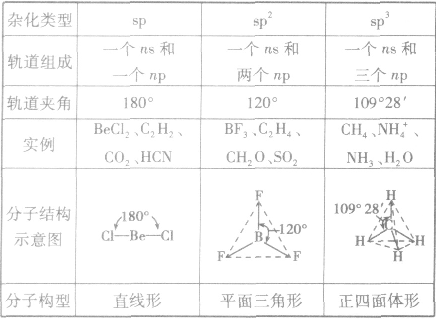
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
晶胞:
1.定义描述晶体结构的基本单元叫做晶胞。
2.结构一般来说,晶胞为平行六面体,晶胞只是晶体微观空间里的一个基本单元,在它的上、下、左、右、前、后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。“无隙”是指相邻晶胞之间没有任何间隙,“并置”是指所有晶胞都是平行排列的,取向相同。
晶胞中微粒数目的确定:
计算晶胞中微粒数目的常用方法是均摊法。均摊法是指每个晶胞平均拥有的粒子数目。如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞。
属于这个晶胞。
(1)长方体(或正方体)形晶胞中不同位置的粒子数的计算。
①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有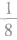 属于该晶胞。
属于该晶胞。
②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有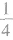 属于该晶胞。
属于该晶胞。
③处于面上的粒子,同时为2个晶胞所共有。每个粒子有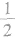 属于该晶胞。
属于该晶胞。
④处于晶胞内部的粒子,则完全属于该晶胞。
(2)非平行六面体形晶胞中粒子数目的计算同样可用均摊法,其关键仍然是确定一个粒子为几个晶胞所共有。例如,石墨晶胞每一层内碳原子排成许多个六边形,其顶点(1个碳原子)对六边形的贡献为 ,那么每一个六边形实际有6×
,那么每一个六边形实际有6× =2个碳原子。
=2个碳原子。
(3)在六棱柱晶胞(如图所示 MgB2的晶胞)中,顶点上的原子为6 个晶胞(同层3个,上层或下层3个) 共有,面上的原子为2个晶胞共有,因此镁原子个数为12×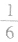 +2×
+2×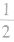 =3,硼原子个数为6。
=3,硼原子个数为6。 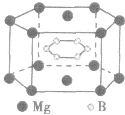
特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定式,不同形状的晶胞应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心上的原子依次被6、3、4、2 个晶胞共用。
有关晶胞密度的计算步骤:
①根据“分摊法”算出每个晶胞实际含有各类原子的个数,计算出晶胞的质量m:
②根据边长计算晶胞的体积V:
③根据 进行计算,得出结果。
进行计算,得出结果。
电离能:
(1)概念
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
(2)元素第一电离能的意义:可以衡量元素的原子在气态时失去一个电子的难易程度。第一电离能数值越小,在气态时原子越容易失去一个电子;第一电离能数值越大,在气态时原子越难失去一个电子。
(3)电离能的变化规律
①随核电荷数递增,元素的第一电离能呈周期性变化。
②同一周期内,随着原子序数的增加,原子半径逐渐变小(稀有气体除外),原子核对外层电子的吸引越来越强,元素的原子越来越难失电子,因此元素的第一电离能呈增大的趋势。同一周期内,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大。
③同一主族,从上到下,随着原子序数的增加,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的吸引越来越弱,元素的原子越来越易失电子,故同一主族,随着电子层数的增加,元素的第一电离能逐渐减小。注意通常ⅡA族元素的第一电离能大于ⅢA 族元素、VA族元素的第一电离能大于ⅥA族元素。这是由于ⅡA、VA族元素原子的价电子排布分别为 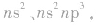 是较稳定的全充满或半充满状态,因而失去电子所需的能量较高。
是较稳定的全充满或半充满状态,因而失去电子所需的能量较高。
与“决定物质性质的重要因素是物质结构。请回答下列问题。(1)已知...”考查相似的试题有:
- X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)...
- 有关化学用语正确的是( )A.乙烯的最简式C2H4B.乙醇的结构简式C2H6OC.四氯化碳的电子式D.硫离子的核外电子排布式1s22s22...
- 短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14.X与Z同主族.Y与W同主族,且X的原子半径小于Y.下...
- 有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色.请...
- 在水溶液中,YO3n-和S2-发生反应的离子方程式为:YO3n-+3S2-+6H+=Y-+3S↓+3H2O(1)YO3n-中Y元素的化合价是______ (2)Y元素...
- XY2是离子化合物,X离子和Y离子的电子层结构都与氖原子相同,则X、Y为[ ]A.Ca和ClB.K和SC.Ca和FD.Mg和F
- (三选一)【化学--物质结构与性质】A、B、C是原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素...
- 如图所示为冰的一种骨架形式,依此为单位向空间延伸,那么该冰中的每个水分子有____个氢键。
- 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_...
- NaCl的晶胞如右图,每个NaCl晶胞中含有的Na+离子和Cl离子的数目分别是( )A.14,13B.1,1C.4,4D.6,6