本试题 “下列说法正确的是( )A.在Na2O2晶体中阳离子与阴离子的物质的量之比为l:1B.离子晶体中一定含有金属阳离子C.水加热到很高的温度都难以分解是因为水分子间...” 主要考查您对胶体
离子晶体
离子键
氢键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 胶体
- 离子晶体
- 离子键
- 氢键
胶体:分散质粒子直径在10-9m~10-7m之间的分散系胶粒直径的大小是胶体的本质特征
胶体可分为固溶胶、液溶胶、气溶胶
①常见的液溶胶:Fe(OH)3、AgI、牛奶、豆浆、粥等
②常见的气溶胶:雾、云、烟等;
③常见的固溶胶:有色玻璃、烟水晶等胶体的性质:
丁达尔效应:
①当光束通过氢氧化铁胶体时,可以看到一条光亮的通路,这条光亮的通路是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,即为丁达尔效应。
②布朗运动:粒子在不停地、无秩序的运动
③电泳:胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里定向移动。一般来讲:金属氢氧化物,金属氧化物的胶粒吸附阳离子,胶体微粒带正电荷;非金属氧化物,金属硫化物的胶体胶粒吸附阴离子,胶体微粒带负电荷。
④胶体聚沉:向胶体中加入少量电解质溶液时,由于加入的阳离子(或阴离子)中和了胶体粒子所带的电荷,使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出。该过程不可逆。
胶体的特性:
(1)丁达尔效应当一束光通过胶体时,胶体内会出现一条光亮的通路,这是由胶体粒子对光线散射而形成的,利用丁达尔效应可区分胶体和浊液。
(2)介稳性:胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,但改变条件就有可能发生聚沉。
(3)聚沉:给胶体加热、加入电解质或加入带相反电荷的胶体颗粒等均能使胶体粒子聚集成较大颗粒,从而形成沉淀从分散剂里析出。聚沉常用来解释生活常识,如长江三角洲的形成、明矾净水等。
(4)电泳现象:在电场作用下,胶体粒子在分散剂中作定向移动。电泳现象说明胶体粒子带电。电泳常用来分离提纯胶体,如工业上静电除尘。
分散系比较:
| 分散系 | 溶液 | 胶体 | 悬浊液 | 乳浊液 |
| 分散质粒子大小 | <1nm | 1~100nm | >100nm | >100nm |
| 分散质粒子结构 | 分子、离子 | 少量分子的结合体或大分子 | 大量分子聚集成的固体小颗粒 | 大量分子聚集成的液体小液滴 |
| 特点 | 均一、透明、稳定 | 多数均一、透明、较稳定 | 不均一、不透明、久置沉淀 | 不均一、不透明、久置分层 |
| 能否透过滤纸 | 能 | 能 | 不能 | —— |
| 实例 | 食盐水、蔗糖溶液 | Fe(OH)3(胶体)、淀粉胶体 | 泥水、石灰乳 | 牛奶、油漆 |
胶体发生聚沉的条件:
因胶粒带电,故在一定条件下可以发生聚沉:
- 向胶体中滴加电解质
- 向胶体中加入带相反电荷胶粒的胶体
- 加热
常见的胶体的带电情况:
- 胶粒带正电荷的胶体有:金属氧化物、金属氢氧化物。例如Fe(OH)3、Al(OH)3等。
- 胶粒带负电荷的胶体有:非金属氧化物、金属硫化物、硅酸胶体、土壤胶体。
- 胶粒不带电的胶体有:淀粉胶体。
- 特殊的,AgI胶粒随着AgNO3和KI相对量不同,而带正电或负电。若KI过量,则AgI胶粒吸附较多I-而带负电;若AgNO3过量,则因吸附较多Ag+而带正电。
注意:胶体不带电,而胶粒可以带电。
Fe(OH)3胶体的制备:
操作步骤:将烧杯中的蒸馏水加热至沸腾,向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至呈红褐色为止。
离子方程式:Fe3++3H2O=(加热)=Fe(OH)3(胶体)+3H+
点拨:(1)淀粉溶液、蛋白质溶液虽叫做溶液,但属于胶体。
(2)胶体可以是液体,也可以是固体、气体,如烟、云、雾、有色玻璃等。
离子间通过离子间结合而形成的晶体,熔点较高、沸点高,导热性、延展性不良,固态不导电、熔融或溶于水导电,脆而硬,如:NaCl
晶体的基本类型与性质:

晶体类型的判断方法:
1.依据晶体的组成微粒与微粒间作用力来判断
离子晶体的组成微粒是阴、阳离子,微粒间作用力是离子键;原子晶体的组成微粒是原子,微粒间作用力是共价键;分子晶体的组成微粒是分子,微粒间作用力是分子间作刚力;金属晶体的组成微粒是金属阳离子和自南电子,微粒间作用力是金属键。
2.依据物质的分类判断
金属氧化物(如K2O、Na2O等)、强碱(如NaOH、 KOH等)和绝大多数的盐是离子晶体。大多数非金属单质(除金刚石、石墨、品体硅、晶体硼以外)、气态氢化物、非金属氧化物(除SiO2以外)、酸、绝大多数有机物 (除有机盐以外)都是分子晶体。常见的属于原子晶体的单质有金刚石、晶体硅、晶体硼、晶体锗等,常见的属于啄子品体的化合物有碳化硅(SiC)、氮化硅(Si3N4)、氮化硼(BN)、二氧化硅(SiO2)等。金属单质与合金是金属晶体.
3.依据晶体的熔点判断
离子晶体熔点较高,常在几百至一千摄氏度。原子晶体熔点高,常在一千至几千摄氏度。分子晶体熔点低,常在几百摄氏度以下至很低的温度。金属晶体的熔点范围最广,钨的熔点比部分原子晶体还要高,汞的熔点比部分分子晶体还要低。
4.依据导电性判断离子晶体水溶液及熔化时能导电、原子晶体一般为非导体。分子晶体为非导体,但分子晶体中的电解质溶于水,使分子内的化学键断裂形成自由离子也能导电。金属晶体是电的良导体。
5.依据硬度和机械性能判断
离子晶体硬度大(或硬而脆);分子晶体硬度较小;原子晶体硬度大;金属晶体多数硬度大,但也有较小的,具有延展性。
定义:
使阴阳离子结合成化合物的静电作用叫离子键。
成键元素:
活泼金属(或NH4+)与活泼的非金属或酸根离子、OH-
静电作用:
指静电吸引和静电排斥的作用
氢键:
(1)概念:已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力。如水分子问的氢键如下图所示。 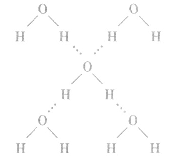
(2)表示方法:A—H…B一(A、B为N、O、F“一” 表示共价键,“…”表示形成的氢键)。
(3)分类
(4)属性:氢键不属于化学键,它属于一一种较强的分子间作用力,其作用能大小介于范德华力和化学键之间。
(5)对物质性质的影响
①氢键对物质熔、沸点的影响。分子问存在氧键时,破坏分子问的氢键,需要消耗更多的能量,所以存在氢键的物质具有较高的熔点和沸点。
例如:氮族、氧族、卤素中的N、O、F的氧化物的熔、沸点的反常现象。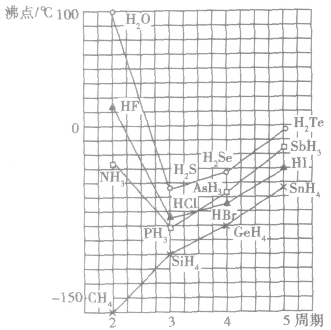
②氢键对物质溶解度的影响:氢键的存在使物质的溶解性增大。例如:NH3极易溶解于水,主要是由于氨分子和水分子之问形成了氢键,彼此互相缔合,因而加大了溶解。再如乙醇、低级醛易溶于水,也是因为它们能与水分子形成氢键。
③氢键的存在会引起密度的变化。水结冰时体积膨胀、密度减小的反常现象也可用氢键解释:在水蒸气中水以单个的水分子形式存在;在液态水中,通常是几个水分子通过氢键结合,形成(H2O)n小集团;在固态水(冰)中,水分子大范围地以氢键互相连接,成为疏松的晶体,因此在冰的结构中有许多空隙,造成体积膨胀,密度减小。
④分子内氢键与分子间氢键对物质性质的不同影响:氢键既可以存在于分子内部的原子之间,也可以存在于分子间的原子之间,只不过这两种情况对物质性质的影响程度是不一样的。例如,邻羟基苯甲醛存在分子内氢键: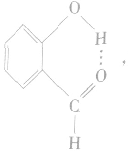 熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键:
熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键: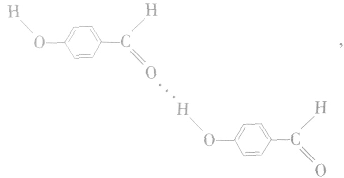 熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
6)存在:水、醇、羧酸、酰胺、氨基酸、蛋白质、结晶水合物等物质中都能存在;生命体中许多大分子内也存在氢键,如氢键是蛋白质具有生物活性的高级结构的重要原因,DNA双螺旋的两个螺旋链也是以氢键相互结合的。
与“下列说法正确的是( )A.在Na2O2晶体中阳离子与阴离子的物质...”考查相似的试题有:
- 能用有关胶体的观点解释的现象是A.在江河入海处易形成三角洲B.0.01mol/LAgNO3溶液中滴入同浓度NaI溶液,看不到黄色沉淀C....
- 下列不存在丁达尔效应的分散系是①有尘埃的空气、②溴水、③蒸馏水、④沸水中加几滴FeCl3浓溶液、⑤淀粉溶液[ ]A.②B.②③⑤C.②③D.①②③⑤
- 下列有关胶体的说法正确的是A.直径介于10-9 m~10-7m之间的微粒称为胶体B.电泳现象可证明胶体带有电荷C.用聚光手电筒照...
- 下列说法中正确的是( )A.氮的固定只有在高温、高压、催化剂的条件下才能实现B.纯净的硅单质的制造光导纤维的基本原料C....
- 在水泥厂、冶金厂、硫酸厂常用高压电对气体作用,除去大量烟尘,以减少对空气的污染。这种做法的原因是 A.胶体凝聚B.过滤气...
- 现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验:甲同学向1mol•L-1氯化铁溶液中加入少量的NaOH溶液;乙同学直接加热...
- 以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问...
- 胶体区别于其他分散系的本质特征是( )A.是混合物B.有丁达尔效应C.属于介稳系统D.粒子大小在1nm~100nm之间
- 不同元素的原子在分子内吸引电子的能力大小可用电负性来表示,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为...
- 下表为元素周期表的一部分,其中的编号代表不同的元素。请回答下列问题:(1)表中属于d区的元素是__________(填编号);元素⑧...