本试题 “实验室用粗盐(食盐和少量不溶性杂质的混合物),配制食盐溶液,并测定溶液密度.操作步骤如下:步骤一:称量一洁净且干燥的烧杯,称得质量为mg;步骤二:将...” 主要考查您对过滤
粗盐的提纯
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 过滤
- 粗盐的提纯
过滤定义:
利用介质滤除水中杂质的方法。
通过特殊装置将流体提纯净化的过程,过滤的方式很多,使用的物系也很广泛,固-液、固-气、大颗粒、小颗粒都很常见。
在推动力或者其他外力作用下悬浮液(或含固体颗粒发热气体)中的液体(或气体)透过介质,固体颗粒及其他物质被过滤介质截留,从而使固体及其他物质与液体(或气体)分离的操作。
过滤归纳:
| 过滤的原理 | 其中一种能溶于水,另一种不能溶于水,则可以先把它们充分溶于水中,再进行过滤分离 |
| 制作过滤器 | 把一张圆形滤纸连续对折两次,得到一个四层的扇形滤纸,然后再用手捏住最外面一层滤纸展开,便得到一个一边是一层,另一边是三层的滤纸,用少量水润湿一下,把它贴在漏斗内壁上即可。 |
| 用到的仪器 | 铁架台(带铁圈)、烧杯、漏斗、玻璃棒、滤纸等 |
| 过滤装置 | 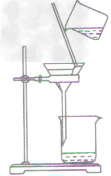 |
| 注意事项 | 操作注意事项有:一贴、二低、三靠。 一贴:滤纸紧贴漏斗内壁,以没有气泡为准,可加快过滤的速度; 二低:滤纸边缘低于漏斗边缘;漏斗内液面低于滤纸边缘,防止液体从滤纸与漏斗之间的间隙流下,使过滤不充分; 三靠:盛待过滤液体的烧杯紧靠引流的玻璃棒,防止液体溅到漏斗外丽;玻璃棒的下端紧靠在三层滤纸上,防止戳破滤纸;漏斗下端长的那侧管口紧靠烧杯内壁,防止液体溅出 |
| 过滤失败的原因 | ①滤纸破损;②过滤时液面高于滤纸边缘; ③收集滤液的烧杯不洁净 |
| 过滤操作实验口诀 | 斗架烧杯玻璃棒,滤纸漏斗角一样。 过滤之前要静置,三靠两低不要忘。 |
粗盐提纯:
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:Ca2+,Mg2+,SO42-等。不溶性杂质可以用过滤的方法除去,可溶性杂质中的Ca2+,Mg2+,SO42-则可通过加入BaCl2、NaOH和Na2CO3溶液,生成沉淀而除去,也可加入BaCO3固体和NaOH溶液来除去。然后蒸发水分得到较纯净的精盐。
粗盐提纯实验:
1. 实验过程:
(1)溶解
(2)在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐。
(3)加入过量BaCl2(去除硫酸根离子)BaCl2+Na2SO4==BaSO4↓+2NaCl
(4)加入过量NaOH(去除镁离子)MgCl2+2NaOH==Mg(OH)2↓+2NaCl
(5)加入过量Na2CO3(去除钙离子及BaCl2中的钡离子)Na2CO3+CaCl2==CaCO3↓+2NaCl
(6)Na2CO3+BaCl2==BaCO3↓+2NaCl
(注:3,4两步可互换。)
(7)过滤
向滤液中加入适量HCl(除去过量NaOH,Na2CO3,可选择用pH试纸控制加入的量,或是直接蒸发)
(8)蒸发结晶
2. 实验步骤:
(1)溶解:
用托盘天平称取5克粗盐(精确到0.1克),用量筒量取10毫升水倒入烧杯里,
用药匙取一匙粗盐加入水中,观察发生的现象,用玻璃棒搅拌,并观察发生的现象。
接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止,观察溶液是否浑浊。
(2)过滤:
将滤纸折叠后用水润湿使其紧贴漏斗内壁并使滤纸上沿低于漏斗口,溶液液面低于滤纸上沿,
倾倒液体的烧杯口要紧靠玻璃棒,玻璃棒的末端紧靠有三层滤纸的一边,漏斗末端紧靠承接
滤液的烧杯的内壁。慢慢倾倒液体,待滤纸内无水时,仔细观察滤纸上的剩余物及滤液的颜色,
滤液仍浑浊时,应该再过滤一次。
(3)蒸发:
把得到的澄清滤液倒入蒸发皿,把蒸发皿放在铁架台的铁圈上,用酒精灯加热同时用玻璃棒
不断搅拌滤液,等到蒸发皿中出现较多量固体时,停止加热,利用蒸发皿的余热使滤液蒸干。
(4)用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器,比较提纯前后食盐的状态
并计算精盐的产率。
(5)去除可溶性杂质:溶解,依次加入过BaCl2,NaOH,Na2CO3过滤。向滤液中加入适量HCl,
蒸发,结晶。
产率计算:
将提纯后的氯化钠与粗盐作比较,计算精盐的产率。
(误差分析:明显偏低:A.溶解时将粗盐一次全部倒入水中,立即过滤B.蒸发时,有一些液体、固体溅出。
偏高:提纯后的精盐尚未完全干燥就称其质量.粗盐中含有其他可溶性固体。)
元素变化:
反应前:NaCl、MgCl2、CaCl2、Na2SO4
加入BaCl2(过量)产生BaSO4沉淀溶液内还剩:NaCl、MgCl2、CaCl2、BaCl2
加入Na2CO3(过量)产生CaCO3沉淀和BaCO3沉淀溶液内还剩:NaCl、MgCl2、Na2CO3
加入NaOH(过量)产生Mg(OH)2沉淀溶液内还剩:NaCl、Na2CO3、NaOH
加入HCl(过量)产生CO2、H2O溶液内还剩:HCl、NaCl
蒸发后:NaCl
实验现象:
溶解:粗盐固体为灰色,加入水中所得液体呈浑浊状。
过滤:滤液是无色透明液体,滤纸上的残留物呈黑色。
蒸发:随着加热,蒸发皿中液体的量减少;当蒸发到一定程度时,蒸发皿底部有固体析出。蒸发得到的固体为白色。
过程中玻璃棒的作用:
(1)溶解时:搅拌,加速溶解
(2)过滤时:引流
(3)蒸发时:搅拌,使液体均匀受热,防止液体飞溅
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:Ca2+,Mg2+,SO42-等。不溶性杂质可以用过滤的方法除去,可溶性杂质中的Ca2+,Mg2+,SO42-则可通过加入BaCl2、NaOH和Na2CO3溶液,生成沉淀而除去,也可加入BaCO3固体和NaOH溶液来除去。然后蒸发水分得到较纯净的精盐。
粗盐提纯实验:
1. 实验过程:
(1)溶解
(2)在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐。
(3)加入过量BaCl2(去除硫酸根离子)BaCl2+Na2SO4==BaSO4↓+2NaCl
(4)加入过量NaOH(去除镁离子)MgCl2+2NaOH==Mg(OH)2↓+2NaCl
(5)加入过量Na2CO3(去除钙离子及BaCl2中的钡离子)Na2CO3+CaCl2==CaCO3↓+2NaCl
(6)Na2CO3+BaCl2==BaCO3↓+2NaCl
(注:3,4两步可互换。)
(7)过滤
向滤液中加入适量HCl(除去过量NaOH,Na2CO3,可选择用pH试纸控制加入的量,或是直接蒸发)
(8)蒸发结晶
2. 实验步骤:
(1)溶解:
用托盘天平称取5克粗盐(精确到0.1克),用量筒量取10毫升水倒入烧杯里,
用药匙取一匙粗盐加入水中,观察发生的现象,用玻璃棒搅拌,并观察发生的现象。
接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止,观察溶液是否浑浊。
(2)过滤:
将滤纸折叠后用水润湿使其紧贴漏斗内壁并使滤纸上沿低于漏斗口,溶液液面低于滤纸上沿,
倾倒液体的烧杯口要紧靠玻璃棒,玻璃棒的末端紧靠有三层滤纸的一边,漏斗末端紧靠承接
滤液的烧杯的内壁。慢慢倾倒液体,待滤纸内无水时,仔细观察滤纸上的剩余物及滤液的颜色,
滤液仍浑浊时,应该再过滤一次。
(3)蒸发:
把得到的澄清滤液倒入蒸发皿,把蒸发皿放在铁架台的铁圈上,用酒精灯加热同时用玻璃棒
不断搅拌滤液,等到蒸发皿中出现较多量固体时,停止加热,利用蒸发皿的余热使滤液蒸干。
(4)用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器,比较提纯前后食盐的状态
并计算精盐的产率。
(5)去除可溶性杂质:溶解,依次加入过BaCl2,NaOH,Na2CO3过滤。向滤液中加入适量HCl,
蒸发,结晶。
产率计算:
将提纯后的氯化钠与粗盐作比较,计算精盐的产率。
(误差分析:明显偏低:A.溶解时将粗盐一次全部倒入水中,立即过滤B.蒸发时,有一些液体、固体溅出。
偏高:提纯后的精盐尚未完全干燥就称其质量.粗盐中含有其他可溶性固体。)
元素变化:
反应前:NaCl、MgCl2、CaCl2、Na2SO
加入BaCl2(过量)产生BaSO4沉淀溶液内还剩:NaCl、MgCl2、CaCl2、BaCl2
加入Na2CO3(过量)产生CaCO3沉淀和BaCO3沉淀溶液内还剩:NaCl、MgCl2、Na2CO3
加入NaOH(过量)产生Mg(OH)2沉淀溶液内还剩:NaCl、Na2CO3、NaOH
加入HCl(过量)产生CO2、H2O溶液内还剩:HCl、NaCl
蒸发后:NaCl
实验现象:
溶解:粗盐固体为灰色,加入水中所得液体呈浑浊状。
过滤:滤液是无色透明液体,滤纸上的残留物呈黑色。
蒸发:随着加热,蒸发皿中液体的量减少;当蒸发到一定程度时,蒸发皿底部有固体析出。蒸发得到的固体为白色。
过程中玻璃棒的作用:
(1)溶解时:搅拌,加速溶解
(2)过滤时:引流
(3)蒸发时:搅拌,使液体均匀受热,防止液体飞溅
发现相似题
与“实验室用粗盐(食盐和少量不溶性杂质的混合物),配制食盐溶...”考查相似的试题有:
- 有下列实验操作:①过滤,②蒸发,③结晶,④乳化,将上述各操作名称的序号填在与之相对应的空格上(1)从硝酸钾饱和溶液中提取硝...
- 下列过滤操作的步骤中,错误的是( )A.如果滤纸高于漏斗边缘,应剪去多余部分,使滤纸的边缘比漏斗口稍低B.用少量水润湿滤...
- “太湖美,美就美在太湖水”.据报导太湖上有近百只餐饮船.为了检测这些船只排放的废水是否达到标准,请你取废水样品设计以下...
- 下图所示的实验操作中正确的是 ( )A.B.C.D.
- 下列各组溶液,不加其它试剂就能鉴别的是A.NaOH、NaCl、MgCl2、FeCl3B.Na2CO3、稀H2SO4、稀HCl、NaNO3C.Na2SO4、BaCl2、KN...
- 某学生用化学知识解决生活中的问题,下列家庭小实验不合理的是( )A.用食醋除去暖水瓶中的薄层水垢B.用米汤检验食盐中是否...
- 鉴别空气、氧气、二氧化碳三瓶气体,最简单的方法是 A.将气体分别通入水中B.将气体分别通入澄清的石灰水中C.将气体分别通...
- 通过海水晾晒可得粗盐,粗盐除NaCl外,还含有Na2SO4、MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程...
- 下图是初中化学中某些常见化合物的转化关系图,其中X是一种重要的建筑材料,A不支持燃烧可用于灭火,B与水反应放出大量热,请...
- A、B、C、D都是初中化学常见的物质。它们之间的转化关系如图所示(“→”表示物质间的转化关系)。(1)若A和D均为单质,B和C是...