本试题 “硫碘循环分解水制氢主要涉及下列反应:Ⅰ.SO2+2H2O+I2=H2SO4+2HIⅡ.2HIH2↑+I2Ⅲ.2H2SO4=2SO2+O2↑+2H2O(1)分析上述反应,下列判断正确的是 。a.反应Ⅲ易在...” 主要考查您对化学反应速率的定义、公式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应速率的定义、公式
化学反应速率:
1.定义:化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
2.表示方法:在容积不变的反应器中,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。即: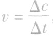
3.单位:mol·L-1·s-1或mol·L-1·min-1等。
4.注意:
(1)化学反应速率是指一段时间内的平均速率,而不是瞬时速率;通常前一段时间的平均反应速率要快于后一段时间的平均反应速率,反应速率均取正值,即v>0。
(2)在一定温度下,固体和纯液体物质单位体积的物质的量保持不变,即物质的量浓度为常数,因此在表示化学反应速率时,不代入固体或纯液体物质的浓度。浓度是指气体或溶液的浓度。
(3)同一个化学反应在相同的条件下、在同一段时间内,用不同物质表示反应速率时,数值可能相同也可能不同,但表达的意义都相同,即反应的快慢程度是一样的。
(4)在同一反应巾用不同的物质来表示反应速率时,其数值之比等于化学方程式中各物质的化学计量数之比.
如化学反应: ,
,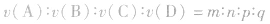 ,所以
,所以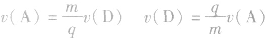
发现相似题
与“硫碘循环分解水制氢主要涉及下列反应:Ⅰ.SO2+2H2O+I2=H2SO...”考查相似的试题有:
- 在2A+B3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是A.v(A)=0.5mol·L-1·min-1 B.v(B)=0.3mol·L-1·min-...
- 在2A(g) + B(g) 3C(g) + 4D(g)中,表示该反应速率最快的是A.υ(A) = 0.6 mol·L-1·s-1 B.υ(B) = 0.6 mol·L-1·s-1C.υ(C...
- 工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)CH3OH(g).(1)图1是反应时CO和CH3OH(g)的浓度随时间变...
- 在2L容器中发生反应N2+3H2 2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol /(L·s...
- 可逆反应2SO2+ O2 2SO3,如果SO2的起始浓度为2 mol/L ,2min后SO2的浓度为1.8mol/L,则用SO2的浓度变化表示的反应速率为:A....
- 一定条件下反应N2(g)+3H2(g)⇌2NH3(g)在密闭容器中进行,测得2min内,N2的物质的量浓度由2mol/L减小到0.8mol/L,则2min...
- (5分)反应混合物A、B、C的物质的量浓度与时间t(s)关系如表所示。该反应方程式为 。用A浓度变化表示200~800 s内反应的平均...
- 关于有效碰撞理论,下列说法正确的是( )A.活化分子间所发生的分子间的碰撞为有效碰撞B.增大反应物浓度能够增大活化分子百...
- 氮可形成多种氧化物,如NO、NO2、N2O4等.(1)对反应N2O4(g)2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强...
- 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.(1)V2O5是接触法制硫酸的催化剂.①一定条件下,SO2与空气反...