本试题 “某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液测定中和热.测定中和热的实验装置如图1所示.(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方...” 主要考查您对中和热的测定
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 中和热的测定
中和热测定:
(1)目的:①用量热法测定HCl与NaOH的中和热。②了解化学标定法,并掌握其操作。
(2)原理:在298K、溶液足够稀的情况下,1molOH-与1molH+中和,可放出57.3.kJ的热量。即:H+(aq)+OH-(aq) =H2O(aq) △H=-57.3kJ/mol
(3)仪器和实验:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。0.50 mol/L 盐酸、0.55 mol/L NaOH溶液。
(4)步骤:
①在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。该实验也可在保温杯中进行。
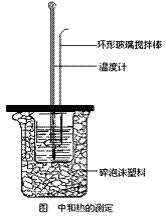
②用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑤重复实验两次,取测量所得数据的平均值作为计算依据。
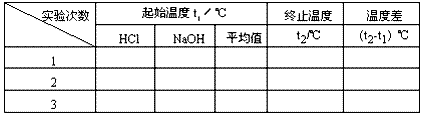
⑥根据实验数据计算中和热。
(1)目的:①用量热法测定HCl与NaOH的中和热。②了解化学标定法,并掌握其操作。
(2)原理:在298K、溶液足够稀的情况下,1molOH-与1molH+中和,可放出57.3.kJ的热量。即:H+(aq)+OH-(aq) =H2O(aq) △H=-57.3kJ/mol
(3)仪器和实验:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。0.50 mol/L 盐酸、0.55 mol/L NaOH溶液。
(4)步骤:
①在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。该实验也可在保温杯中进行。

②用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑤重复实验两次,取测量所得数据的平均值作为计算依据。

⑥根据实验数据计算中和热。
发现相似题
与“某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液测定中和...”考查相似的试题有:
- 在下列实验方法合理的是[ ]A.可用水鉴别K2SO4、NaOH、NaCl三种固体B.可用铁粉除去FeCl2溶液中的少量的CuCl2C.可用澄清石灰...
- 实验室利用下图装置进行中和热的测定。(1)下列所用的仪器和试剂正确的一组是( )。A.0. 50 mol·L-1盐酸,0. 50 mol·L-1NaOH溶...
- 下列说法正确的是( )A.可用碘水鉴别苯、四氯化碳、乙醇三种无色液体B.取11.7gNaCl固体于烧杯中,加入200mL蒸馏水(ρ=1g/c...
- 下列说法正确的是[ ]A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大C.乙酸与乙醇...
- 50mL 1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液在下图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算...
- 下列实验指定使用的仪器必须预先干燥的是( )①中和热测定中所用的小烧杯 ②中和滴定中所用的锥形瓶 ③配置一定物质的量浓度溶...
- 下列说法正确的是( ) A.中和热测定实验中以环形铜丝代替环形玻璃搅拌棒会使测定值比理论值偏高 B.除去溴乙烷中溶解的溴,...
- 50 mL1.0 mol·L-1盐酸跟50mL1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热...
- 为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol/L)反应过程中的热效应,进行实验并测得如 下数据由此得出的结论正确的...
- 下列有关几个定量实验的说法,正确的是______(填序号)A.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出B...