本试题 “下列说法中不正确的是( )A.自然界中的铁主要以化合物的形式存在于矿石中B.工业上炼铁的主要设备是高炉C.工业上炼铁的原理是Fe2+3CO 高温 . 2Fe+3COD.工...” 主要考查您对金属的物理性质和用途
金属的冶炼(铁的冶炼)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 金属的物理性质和用途
- 金属的冶炼(铁的冶炼)
概述:
金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。金属的上述特质都跟金属晶体内含有自由电子有关。在自然界中,绝大多数金属以化合态存在,少数金属例如金、铂、银、铋以游离态存在。金属矿物多数是氧化物及硫化物。其他存在形式有氯化物、硫酸盐、碳酸盐及硅酸盐。金属之间的连结是金属键,因此随意更换位置都可再重新建立连结,这也是金属伸展性良好的原因。金属元素在化合物中通常只显正价。
金属物理性质的共性:
大多数金属在常温下是固体,具有金属光泽,是电和热的良导体,具有良好的延展性,密度较大,熔沸点较高。
金属物理性质的特性:
不同的金属有其各自的特性。如铁、铝等大多数金属都呈银白色,但铜呈红色,金呈黄色;常温下,铁、铝、铜等大多数金属都是固体,但汞是液体;不同金属的导电性、导热性、密度、熔点、硬度等物理性质差别也较大,见下表。
用途:
钛和钛的合金:可用于制造喷气发动机,轮船外壳,反应器和电信器材。
锌:锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
铜:制造电线、电缆和各种电器。
铝:来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
物质的性质和用途的关系:
①物质的性质在很大程度上决定了物质的用途,但实际运用时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
②应用举例
a.日常生活中菜刀、镰刀、锤子等用铁制而不用铅制,这是因为铁的硬度比铅大,并且铅对人体有害。
b.虽然银的导电性比铜好,但由于银的价格比铜高得多,所以电线一般用铜制而不用银制。
c.灯泡里的灯丝用钨制而不用锡制,这是因为钨是熔点最高的金属,高温时钨丝不易熔化;而锡的熔点最低 (只有232℃),如果用锡制灯丝,只要一开灯,灯丝就会断开,灯泡不能发光。 d.铁制水龙头要镀铬,这是因为镀铬既美观,又耐腐蚀,可延长水龙头的使用寿命。
e.在日常生活中我们还经常用到其他金属,如温度计中的液态金属汞、干电池的锌皮、热水瓶内胆上镀的金属银等。
金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。金属的上述特质都跟金属晶体内含有自由电子有关。在自然界中,绝大多数金属以化合态存在,少数金属例如金、铂、银、铋以游离态存在。金属矿物多数是氧化物及硫化物。其他存在形式有氯化物、硫酸盐、碳酸盐及硅酸盐。金属之间的连结是金属键,因此随意更换位置都可再重新建立连结,这也是金属伸展性良好的原因。金属元素在化合物中通常只显正价。
金属物理性质的共性:
大多数金属在常温下是固体,具有金属光泽,是电和热的良导体,具有良好的延展性,密度较大,熔沸点较高。
金属物理性质的特性:
不同的金属有其各自的特性。如铁、铝等大多数金属都呈银白色,但铜呈红色,金呈黄色;常温下,铁、铝、铜等大多数金属都是固体,但汞是液体;不同金属的导电性、导热性、密度、熔点、硬度等物理性质差别也较大,见下表。
| 物理性质 | 物理性质比较 |
| 导电性 |  |
| 密度 |  |
| 熔点 |  |
| 硬度 |  |
用途:
钛和钛的合金:可用于制造喷气发动机,轮船外壳,反应器和电信器材。
锌:锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
铜:制造电线、电缆和各种电器。
铝:来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
物质的性质和用途的关系:
①物质的性质在很大程度上决定了物质的用途,但实际运用时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
②应用举例
a.日常生活中菜刀、镰刀、锤子等用铁制而不用铅制,这是因为铁的硬度比铅大,并且铅对人体有害。
b.虽然银的导电性比铜好,但由于银的价格比铜高得多,所以电线一般用铜制而不用银制。
c.灯泡里的灯丝用钨制而不用锡制,这是因为钨是熔点最高的金属,高温时钨丝不易熔化;而锡的熔点最低 (只有232℃),如果用锡制灯丝,只要一开灯,灯丝就会断开,灯泡不能发光。 d.铁制水龙头要镀铬,这是因为镀铬既美观,又耐腐蚀,可延长水龙头的使用寿命。
e.在日常生活中我们还经常用到其他金属,如温度计中的液态金属汞、干电池的锌皮、热水瓶内胆上镀的金属银等。
金属冶炼:
金属冶炼是把金属从化合态变为游离态的过程
矿石
①工业上能用来提炼金属的矿物叫做矿石。
②常见的矿石赤铁矿(Fe2O3)、黄铁矿(FeS2)、褐铁矿(Fe2O3·xH2O)、水铝石(Al2O3·H2O)、菱铁矿(主要成分是FeCO3)、磁铁矿(Fe3O4)、方铅矿(PbS)、孔雀石 [Cu2(OH)2CO3]、赤铜矿(Cu2O)、铝土矿(主要成分是Al2O3)、黄铜矿(主要成分是CuFeS2)、辉铜矿(主要成分是Cu2S)。
铁的冶炼
①原理:把铁矿石冶炼成铁是一个复杂的过程,其主要的反应原理是:
在高温下,利用还原剂一氧化碳把铁从铁矿石里还原出来,其反应的化学方程式是: Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
②炼铁的原料及作用:
铁矿石:提供原料
焦炭:提供能量,产生还原剂
石灰石:将矿石中的二氧化硅转变为炉渣。
③设备:高炉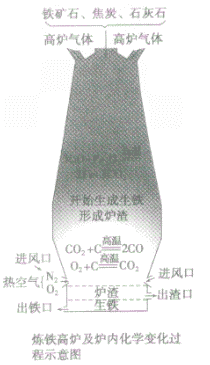
④高炉内有关反应:
a.产生CO提供能量:C+O2 CO2;CO2+C
CO2;CO2+C 2CO
2CO
b.在高温下用CO将Fe从Fe2O3中还原出来:3CO+ Fe2O3 2Fe + 3CO2
2Fe + 3CO2
c.用石灰石将矿石中的SiO2转变为炉渣除去。
CaCO3 CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2 CaSiO3
CaSiO3
⑤产品:生铁
炼铁高炉中出铁口低于出渣口的原因:
炼铁高炉中出铁口与出渣口的高低取决于铁水和炉渣的密度〔铁水的密度大于炉渣的密度)。
金属的冶炼方法:
①热分解法(适用于Hg,Ag不活泼的金属的冶炼,加热使其氧化物分解) 如:
2HgO=Hg+O2↑
②热还原法(适用于金属活动性顺序表中,Zn- Cu金属的冶炼)
a.用H2作还原剂(优点:制得金属纯度高,污染小) 如:Fe3O4+4H2 3Fe+4H2O
3Fe+4H2O
b.用焦炭、一氧化碳作还原剂(易混入杂质,污染大气,适合工业化大规模生产) 如:
炼铁的反应方程式为Fe2O3+3CO 2Fe +3CO2
2Fe +3CO2
炼锌的反应万程式为2ZnO+C 2Zn+CO2↑
2Zn+CO2↑
c.用Al作还原剂(铝热剂用来焊接铁轨) 如:
8Al+3Fe3O4 9Fe+4Al2O3
9Fe+4Al2O3
d.电解法(适用于活泼金属Na,Mg等的冶炼) 如:
2NaCl(熔融) 2Na+Cl2↑ ;MgCl2(熔融)
2Na+Cl2↑ ;MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
e.湿法冶金(从溶液中通过化学反应来获取金属) 如:
Fe+CuSO4==Cu+FeSO4
金属冶炼是把金属从化合态变为游离态的过程
矿石
①工业上能用来提炼金属的矿物叫做矿石。
②常见的矿石赤铁矿(Fe2O3)、黄铁矿(FeS2)、褐铁矿(Fe2O3·xH2O)、水铝石(Al2O3·H2O)、菱铁矿(主要成分是FeCO3)、磁铁矿(Fe3O4)、方铅矿(PbS)、孔雀石 [Cu2(OH)2CO3]、赤铜矿(Cu2O)、铝土矿(主要成分是Al2O3)、黄铜矿(主要成分是CuFeS2)、辉铜矿(主要成分是Cu2S)。
铁的冶炼
①原理:把铁矿石冶炼成铁是一个复杂的过程,其主要的反应原理是:
在高温下,利用还原剂一氧化碳把铁从铁矿石里还原出来,其反应的化学方程式是: Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2 ②炼铁的原料及作用:
铁矿石:提供原料
焦炭:提供能量,产生还原剂
石灰石:将矿石中的二氧化硅转变为炉渣。
③设备:高炉

④高炉内有关反应:
a.产生CO提供能量:C+O2
 CO2;CO2+C
CO2;CO2+C 2CO
2COb.在高温下用CO将Fe从Fe2O3中还原出来:3CO+ Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 c.用石灰石将矿石中的SiO2转变为炉渣除去。
CaCO3
 CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2 CaSiO3
CaSiO3⑤产品:生铁
炼铁高炉中出铁口低于出渣口的原因:
炼铁高炉中出铁口与出渣口的高低取决于铁水和炉渣的密度〔铁水的密度大于炉渣的密度)。
金属的冶炼方法:
①热分解法(适用于Hg,Ag不活泼的金属的冶炼,加热使其氧化物分解) 如:
2HgO=Hg+O2↑
②热还原法(适用于金属活动性顺序表中,Zn- Cu金属的冶炼)
a.用H2作还原剂(优点:制得金属纯度高,污染小) 如:Fe3O4+4H2
 3Fe+4H2O
3Fe+4H2O b.用焦炭、一氧化碳作还原剂(易混入杂质,污染大气,适合工业化大规模生产) 如:
炼铁的反应方程式为Fe2O3+3CO
 2Fe +3CO2
2Fe +3CO2炼锌的反应万程式为2ZnO+C
 2Zn+CO2↑
2Zn+CO2↑ c.用Al作还原剂(铝热剂用来焊接铁轨) 如:
8Al+3Fe3O4
 9Fe+4Al2O3
9Fe+4Al2O3 d.电解法(适用于活泼金属Na,Mg等的冶炼) 如:
2NaCl(熔融)
 2Na+Cl2↑ ;MgCl2(熔融)
2Na+Cl2↑ ;MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑ e.湿法冶金(从溶液中通过化学反应来获取金属) 如:
Fe+CuSO4==Cu+FeSO4
发现相似题
与“下列说法中不正确的是( )A.自然界中的铁主要以化合物的形...”考查相似的试题有:
- 铝能制成铝箔是因为铝具有A.延展性B.导电性C.导热性D.抗腐蚀性
- (7分)人类的生产、生活离不开金属。(1)地壳中含量最高的金属元素是 。(2)用铜制电线主要是利用铜具有良好的延展性和 性...
- 如图是甲、乙、丙、丁四种常见金属与盐酸反应的比较示意图.(1)上述四种金属可以分为两类,其中哪几种金属可以归为一类?(...
- 没有金属,生活是难以想象的.请你根据所学知识回答下列问题:(1)只要观察一下你的周围,你就能理解金属是多么有用.在一百...
- 请从铜、锌、钛、铁、钙、银、铝、汞、钨等中选取合适的答案填入下面空格中:(1)用于干电池的是______;(2)广泛地应用于...
- 材料一:2011年5月13日,媒体曝光了一则“五角硬币制作手镯”的骗局,不法商贩宣称五角硬币的材质是纯铜且能重新熔铸成手镯。材...
- 金属铝是由______(填“分子”、“原子”或“离子”)构成的。铝的抗腐蚀性能较好,其原因是________________________.但铝制的容器...
- 某同学用如图所示装置模拟炼铁化学原理,他的操作及观察到现象正确的是A.反应前先加热再通入一氧化碳B.将反应后的气体通入...
- 对于木炭,一氧化碳和氢气分别跟氧化铜的反应(在适当条件下)下列叙述正确的是( )A.都是还原剂B.都是置换反应C.都有二...
- (1)高炉中用赤铁矿炼铁的主要化学方程式为______,其中氧化铁中的氧被夺去,发生______反应.物质发生氧化反应的元素,其化...