本试题 “研究SO2、CO等大气污染物的处理与利用具有重大意义。Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)n(HSO3-)变化关...” 主要考查您对焓变、反应热
中和热
燃烧热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 焓变、反应热
- 中和热
- 燃烧热
反应热,焓变:
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
中和热:
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法: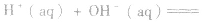
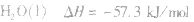
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法:
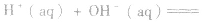
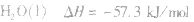
影响中和热测定的因素:
中和反应巾放出的热量为(m1+m1)·c·(t1-t2),其巾溶液的比热容c是已知的,对于给定的反应物的质量m1和m2也是定值,这样求算出的中和热是否接近 57.3kl·mol-1,取决于溶液温度的变化。
在整个实验过程中应把好两关:①隔热关。如:小烧杯周围的泡沫塑料要填满;盖板上两孔只要正好使温度计和环形玻璃搅拌棒通过即可;倒人NaOH溶液要迅速等,尽可能减少实验过程中热量的散失。②准确关。如:配制溶液的浓度要准;NaOH溶液要新制,因为久置的NaOH溶液可能变质导致浓度不准;量取液体体积时读数要准;对溶液温度要读到最高点。
注意事项:
(1)这里的溶液一般要求是稀溶液,这是因为浓酸溶液和浓碱溶液相互稀释时会放出热量
(2)强酸与强碱的反应实质是H+和OH-反应(即与酸、碱的种类无关),通过多次实验测定,1molH+和1molOH-反应生成lmol H2O(l)时,放出的热量为 57.3kJ
(3)中和热是以生成1molH2O为基准的,因此表示中和热的热化学方程式中,水的化学计量数为1,酸、碱的化学计量数可以为分数
燃烧热:
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如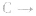
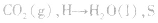
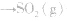 等
等
(4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
燃烧热和中和热的异同:
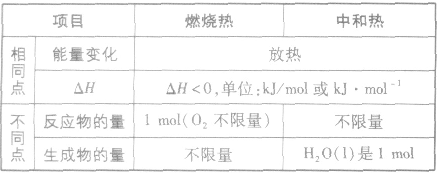
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如
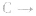
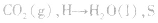
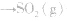 等
等 (4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
发现相似题
与“研究SO2、CO等大气污染物的处理与利用具有重大意义。Ⅰ.利用钠...”考查相似的试题有:
- 下列各项表述正确的是[ ]A. H2(g)+1/2O2(g)==H2O(l) ΔH1=+285.8 kJ/mol;ΔH1是氢气的燃烧热B. C(s)+1/2O2(g)==CO(g) ΔH2= -...
- NOx是汽车尾气中的主要污染物之一。(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .(2)汽车发动机工作时会引发N2...
- 已知:① 2CO(g)+O2(g)===2CO2(g) ΔH=-568kJ/mol② H2(g)+1/2O2(g)=H2O(g) ΔH=―248kJ·mol-1已知CO和H2的混合物1mol在...
- 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如下图所示。下列说法不正确的是A.该反应是放热...
- (16分)汽车尾气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOX、碳氢化合物转化成无毒物质,从而减少...
- 已知:P4(s、白磷) + 5O2(g) = P4O10(s) ΔH =" a" kJ/molP (s、红磷) + 5/4 O2(g) = 1/4P4O10(s) ΔH =" b" kJ/mol试写出白磷...
- 已知25 ℃、101 kPa时,1 mol H2与溴蒸气完全反应生成气态溴化氢放出能量Q kJ,则下列热化学方程式书写正确的是 ( )。A.H2(g)...
- 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图,已知断裂1molN-N吸收167kJ热量,生成1...
- (14分)CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。(1)金刚石和石墨燃烧反应中的能量变化...
- 下列表示物质变化的化学用语正确的是A.已知在298K时下述反应的有关数据:C(s) + 1/2 O2(g) =" CO(g)" △H1=-110.5 kJ·mol-1C...