本试题 “2010年上海世博会主题“城市.让生活更美好”,创建绿色环保,人和自然和谐相处是我们追求的目标,其中化学与生活、社会密切相关.下列说法不正确的是( )A....” 主要考查您对单质铝
三氧化硫
食品添加剂的使用
燃料和能源(氢能、风能、核能、太阳能等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铝
- 三氧化硫
- 食品添加剂的使用
- 燃料和能源(氢能、风能、核能、太阳能等)
铝的主要性质:
- 物理性质:
铝是银白色,具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。 - 化学性质:
活泼金属,具有较强的还原性;常温下铝在浓硫酸和浓硝酸中发生钝化;既可以与酸反应又可以与碱反应。
(1)与氧气反应: (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光)
(2)与Cl2 、S 、N2反应: (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)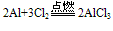
 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑)
(3)与水反应: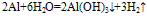
(4)与酸反应: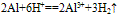
(5)与碱的反应:
(6)铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe - 铝的用途
纯铝制作导线,铝合金用于制造飞机、汽车、生活用品等。
铝的特殊性质:
铝既能与酸反应,也能与强碱反应。
铝与酸反应:铝与浓硫酸在常温下发生钝化,2Al+6HCl==2AlCl3+3H2↑
铝与碱反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑
铝热反应:
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。此种反应被称为铝热反应。
可简单认为是铝与某些金属氧化物(如Fe2O3、Fe3O4、Cr2O3、V2O5等)或非金属氧化物(如SiO2等)在高热条件下发生的反应。
铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应,
其中镁条为引燃剂,氯酸钾为助燃剂。
其装置如下图所示: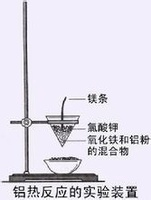
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,然后便可得到Al为8,Fe为9。
镁铝的化学性质比较:
| 单质 | 镁 | 铝 |
| 与非金属反应 | 2Mg+O2=(点燃)=2MgO (发出耀眼白光) Mg+Cl2=(点燃)=MgCl2 3Mg+N2=(点燃)=Mg3N2 |
4Al+3O2=(加热)=2Al2O3 2Al+3Cl2=(加热)=2AlCl3 2Al+3S=(加热)=Al2S3 |
| 与沸水反应 | Mg+2H2O=(加热)=Mg(OH)2+H2↑ | 不反应 |
| 与酸反应 | Mg+2H+==Mg2++H2↑ 与稀硝酸反应生成Mg(NO3)2、NOx(或者N2、NH4NO3)、H2O |
2Al+6H+==2Al3++3H2↑ 在冷的浓硝酸或浓硫酸中钝化 |
| 与氧化物反应 | 2Mg+CO2=(点燃)=2MgO+C (剧烈燃烧,生成白色粉末和黑色固体) |
2Al+Fe2O3=(高温)=2Fe+Al2O3(铝热反应) |
| 与盐溶液反应 | Mg+2NH4++2H2O==Mg2++2NH3·H2O+H2↑ Mg+Cu2+==Mg2++Cu |
2Al+3Hg2+=2Al3++3Hg |
| 与强碱反应 | 不反应 | 2Al+2OH-+2H2O==2AlO2-+3H2↑ |
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,底下便可得到Al为8,Fe为9。
铝与酸、碱反应的计算技巧:
铝与酸、碱反应的实质都是 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: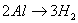 ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。
铝与酸或碱溶液反应生成H2的量的计算:
Al是我们中学阶段学习的唯一既与H+反应也与OH-反应的金属,它与酸、碱反应既有相同点,也有不同点。
相同点:Al均被氧化成+3价,所以1molAl不论与H+还是与OH-反应均生成3gH2。
不同点:1molAl与H+反应消耗3molH+,而与OH-反应只消耗1molOH-,所以含有等物质的量的NaOH溶液和HCl溶液分别与足量的铝反应时生成的氢气的物质的量之比为3∶1。

“铝三角”关系:
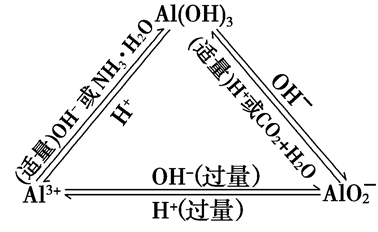
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
钝化:
铝、铁在常温下与浓硫酸发生钝化,钝化不是不反应,而是被氧化成一层致密的氧化物薄膜,恰恰说明金属的活泼性。
三氧化硫:
分子式:SO3,是含极性键的非极性分子,固态时为分子晶体。
三氧化硫的物理性质和化学性质:
1.物理性质:无色易挥发的晶体,熔点为16.8℃,沸点为44.8℃,易升华。
2.化学性质:SO3表现出酸性氧化物的通性。
(1)与水反应: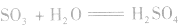 ,SO3遇水剧烈反应生成硫酸,同时放出大量的热,三氧化硫是硫酸的酸酐,又叫硫酐。
,SO3遇水剧烈反应生成硫酸,同时放出大量的热,三氧化硫是硫酸的酸酐,又叫硫酐。
(2)与碱反应:

(3)与碱性氧化物反应:
3.SO3的制法:
(1)着色剂:分天然和人造 胡萝卜素、胭脂红、柠檬黄、苋菜红、(苏丹红)婴儿食品不加色素
(2)调味剂:食盐咸,过多会高血压,味精过多过敏口渴等,醋有酸味
(3)防腐剂:食盐、糖、醋、苯甲酸钠、硝酸盐、二氧化硫、亚硝酸钠(可变成亚硝胺)
(4)营养强化剂:食盐中加碘(KIO3)、酱油中加铁、粮食中加赖氨酸、食品加维生素、钙、硒、锗
1.能源的分类:

2.各种能源的特点:
(1)传统燃料。柴草是农村使用的重要能源,但它的利用率低,且污染严重。
(2)化石燃料。这是人们目前使用的主要能源,它们的蕴藏量有限,而且不能再生,最终会枯竭,属于不可再生能源。
(3)新能源。新能源来源丰富,多数可以再生,没有污染或污染很小,所以可能成为未来的主要能源,但它们也有自己的缺点,如太阳能的能量密度低,使用成本高;氢能储仔、运输困难;风能不稳定,受地区、季节、气候的影响大。
3.我国的能源状况
(1)能源种类。我国的能源种装有化石燃料、水能和核能,其中化石燃料和水能的人均值太低,核能—一铀已探日月的储量很低,仅够4000万干瓦核电站运行 30年。
(2)我国能源的总消费量和人均消费量从改革开放以来~直到1995年逐年增加,从1995年开始有减少的趋势。
(3)我国能源利用率低,只有9%,能源节约的空间很大。
4.使用化石燃料的利弊及新能源的开发
(1)燃料充分燃烧的两个条件:
①要有足够的空气;
②燃料与空气要有足够大的接触面积。
(2)重要的化石燃料:煤、石油、天然气
(3)煤作燃料的利弊问题:
①煤是重要的化工原料;
②煤直接燃烧时产生SO2等有毒气体和烟尘,对环境造成严重污染;
③煤作为固体燃料,燃烧反应速率小,热利用率低,且运输不方便;
④可以通过清洁煤技术,如煤的液化和气化以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
(4)新能源的开发:
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发新能源等;
②现在正在探索的新能源有太阳能、地热能、海洋能、生物质能、风能和氢能等。
与“2010年上海世博会主题“城市.让生活更美好”,创建绿色环保,...”考查相似的试题有:
- A溶液含有中学化学常见的离子,向其中加入NaOH溶液后,生成白色沉淀与加入NaOH 溶液的体积的变化曲线如图所示。下列叙述有错...
- 在一定条件下有以下转化关系,已知A、B、C中均含有同种元素。请回答下列问题。 (1)若D为日常生活中最常见的金属单质之一,...
- 下列反应所得溶液中只含一种溶质的是A.A1Cl3溶液中滴入过量NaOH溶液B.Fe2(SO4)3溶液中加入过量铁粉C.稀HNO3中加入少量铜片...
- 下列化学反应中,能得到单质铝的是A.Al2O3与盐酸反应B.Al2O3与NaOH反应C.高温下灼烧Al(OH)3D.电解熔融Al2O3
- (9分)将3.9g的镁铝合金粉末放于过量的盐酸中,产生的气体体积在标况下是4.48L。请计算:(1)合金中镁的质量分数;(2)合金中...
- 下列情况可能引起大气污染的是①煤的燃烧;②工业废气的任意排放;③燃放鞭炮;④飞机、汽车尾气的排放( )A.只有①②B.只有②④C...
- 铝制器皿能够盛放的物质是A.KOH溶液B.浓硫酸C.NaOH溶液D.稀硫酸
- 下列说法正确的是[ ]A.碘盐中的碘可以直接用淀粉检验B.凡含有食品添加剂的食物对人体健康均有害,不可食用C.棉、麻、丝、...
- “可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观像冰.1体积“可燃冰”可贮载100~200体积的天然气.下...
- 在相同条件下,对环境污染程度最小的燃料是( )A.液化石油气B.天然气C.柴油D.煤