本试题 “在pH=1的无色透明溶液中不能大量共存的离子组是( )A.Al3+Ag+NO3-Cl-B.Mg2+NH4+NO3-Cl-C.Ba2+K+S2-Cl-D.Zn2+Na+NO3-SO42-” 主要考查您对离子共存
溶解度的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子共存
- 溶解度的计算
离子共存:
所谓离子共存实质上就是看离子间是否发生反应。若离子在溶液中发生反应,就不能共存。
判断离子是否共存的几种情况:
(1)发生复分解反应,离子不能大量共存。
①有气体产生 如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
②有沉淀生成 如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
③有弱电解质生成 如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-与H+不能大量共存;
一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
(2)发生氧化还原反应,离子不能大量共存
①具有较强还原性的离子不能与具有较强氧化性的离子大量共存 如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存 如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O不能共存 ;H+与S2O32-不能大量共存。
(3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
(4)溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
(2)溶液的颜色:有色离子MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)、Fe(SCN)2+(红)、Fe(SCN)63-(血红)。
(3)要求“大量共存”还是“不能大量共存”。
所谓离子共存实质上就是看离子间是否发生反应。若离子在溶液中发生反应,就不能共存。
因能发生氧化还原反应而不共存的离子有:
(注:“√”表示能发生反应,“×”表示不能发生反应)
|
|
S2- |
SO32- |
I- |
Fe2+ |
Br- |
Cl-(H+) |
|
MnO4- |
√ |
√ |
√ |
√ |
√ |
√ |
|
ClO- |
√ |
√ |
√ |
√ |
√ |
√ |
|
NO3-(H+) |
√ |
√ |
√ |
√ |
√ |
× |
|
Fe3+ |
√ |
√ |
√ |
× |
× |
× |
因能发生复分解反应而不共存的离子有:
- 离子间相互结合生成难溶物或微溶物
Ba2+、Ca2+ CO32-、SO32-、SO42- Ag+ CO32-、SO32-、Cl- - 离子间相互结合生成气体或挥发性物质
H+ CO32-、HCO3-、SO32-、HSO3-、S2-、HS- OH- NH4+ - 离子间相互结合生成弱电解质
H+ CO32-、SO32-、S2-、CH3COO-、F- 弱酸 OH- NH4+、Al3+、Fe3+、Cu2+、Mg2+ 弱碱 H+ 水
因能发生双水解的离子有:
| Al3+ | CO32-、HCO3-、SO32-、HSO3-、S2-、HS-、AlO2-、ClO- |
| Fe3+ | CO32-、HCO3-、AlO2-、ClO- |
| NH4+ | SiO32-、AlO2- |
因发生络合反应而不共存的离子有:
| Fe3+ | SCN- |
| Ag+、Cu2+ | NH3·H2O |
判断离子是否共存的几种情况:
(1)发生复分解反应,离子不能大量共存。
①有气体产生 如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
②有沉淀生成 如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
③有弱电解质生成 如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-与H+不能大量共存;
一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
(2)发生氧化还原反应,离子不能大量共存
①具有较强还原性的离子不能与具有较强氧化性的离子大量共存 如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存 如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O不能共存 ;H+与S2O32-不能大量共存。
(3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
(4)溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
(2)溶液的颜色:有色离子MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)、Fe(SCN)2+(红)、Fe(SCN)63-(血红)。
(3)要求“大量共存”还是“不能大量共存”。
溶解度的计算:
溶解度的计算公式:S=100m质/m剂(一定温度下的饱和溶液)
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)
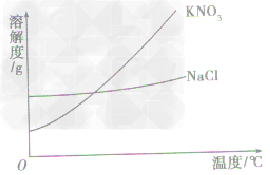
(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
溶解度的计算公式:S=100m质/m剂(一定温度下的饱和溶液)
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)

(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
发现相似题
与“在pH=1的无色透明溶液中不能大量共存的离子组是( )A.Al3+A...”考查相似的试题有:
- 下列各组离子在指定条件下一定能大量共存的是( )A.在加入铝粉能产生氢气的溶液中:B.能使淀粉碘化钾试纸变蓝的溶液中:C....
- 将等浓度的K2S溶液和NaHSO4溶液等体积混合,得到的溶液中离子浓度关系正确的是 A.c(K+)>c(Na+)>c(H+)>c(OH)B.c(Na+)+c(K+)+...
- 常温下,下列各组离子在指定溶液中能大量共存的是[ ]A.无色透明的溶液中:NO3-、SO42-、Ca2+、Fe3+B.pH=12的溶液中:AlO2-...
- 下列各组离子一定能大量共存的是A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—B.在强碱溶液中:Na+、K+、AlO2—、CO32—C....
- 下列各离子可以大量共存、加入括号中的试剂,可以形成无色澄清溶液的是( )A.Mg2+、Cu2+、NO3-(稀盐酸)B.Ag+、Al3+、NO3...
- 下列各组离子在溶液中能大量共存的是( )A.NH4+、K+、Cl-、OH-B.H+、Na+、NO3-、HCO3-C.Mg2+、NH4+、NO3-、SO42-D.Ag+、...
- 下列各组离子在溶液中能大量共存的是( )A.Cu2+、Mg2+、SO42-、NO3-B.H+、Mg2+、SO42-、ClO-C.Ag+、Na+、NO3-、Cl-D.NH4...
- 在强酸性的无色溶液中一定能大量共存的离子组是( )A.Na+、K+、Cl-、CO32-B.Na+、Ba2+、NO3-、SO42-C.Mg2+、K+、Cl-、SO4...
- 下列溶液一定显酸性的是( ) A.溶液中c(OH-)>c(H+) B.滴加紫色石蕊试液后变红色的溶液 C.溶液中c(H+)=10-6 mol/L ...
- 25℃,下列溶液的酸性最强的是( ) A.0.01mol•L-1HCl B.pH=2的H2SO4溶液 C.c(OH-)=10-13mol•L-1 D.pH=1溶液加水稀释1倍