本试题 “选修《物质结构》三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键...” 主要考查您对杂化轨道理论(中心原子杂化方式)
配合物理论
元素周期表
电负性
氢键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 杂化轨道理论(中心原子杂化方式)
- 配合物理论
- 元素周期表
- 电负性
- 氢键
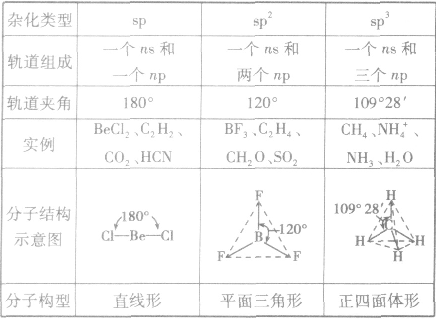
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
配位键、配合物:
1.配位键配位键是一种特殊的共价键。成键的两个原子间的共用电子对是由一个原子单独提供的。形成配位键的条件是其中一个原子有孤电子对,另一个原子有接受孤电子对的“空轨道”。配位键用A→B表示,A是提供孤电子对的原子,B是接受孤电子对的原子。
2.配合物通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配合物。
3.配位键的形成
(1) 中配位键的形成
中配位键的形成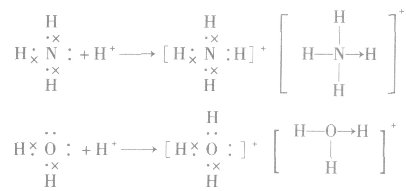
注意:结构式中“→”表示配位键及其共用电子对的提供方式。
(2)配离子 中配位键的形成
中配位键的形成
在 里,NH3分子中的氮原子给出孤电子对,
里,NH3分子中的氮原子给出孤电子对, 接受电子对,以配位键形成了
接受电子对,以配位键形成了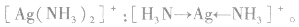
(3)配离子 的形成
的形成
在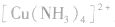 里,
里, 分子中的氮原子给出孤电子对,
分子中的氮原子给出孤电子对, 接受电子对,以配位键形成了
接受电子对,以配位键形成了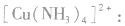
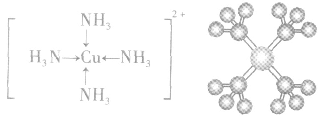
4.配合物的组成
配合物的组成包含中心原子、配体和配位原子、配位数,内界和外界等。以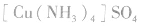 为例说明,如下图所示:
为例说明,如下图所示: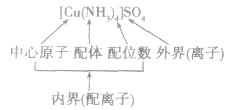
配合物的内界和外界之间多以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离但程度非常小,可谓“强中有弱”。例如,配合物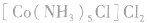 溶液中加入
溶液中加入 溶液,外界的
溶液,外界的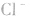 能被沉淀,而内界的
能被沉淀,而内界的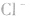 不能形成沉淀。
不能形成沉淀。
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
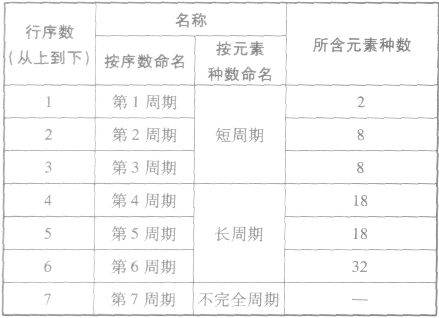
(2)族
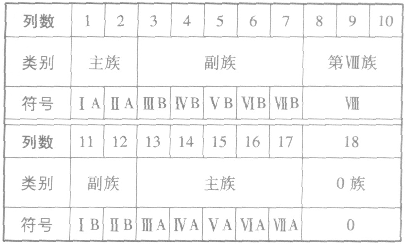
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
(3)元素周期表中主族元素金属性和非金属性的递变
电负性:
(1)键合电子、电负性的定义
元素相互化合时,原子中用于形成化学键的电子称为键合电子。电负性用来描述不同元素的原子对键合电子吸引力的大小。
(2)电负性的意义:电负性越大的原子,对键合电子的吸引力越大。
(3)电负性大小的标准:以氟的电负性为4.0作为相对标准。
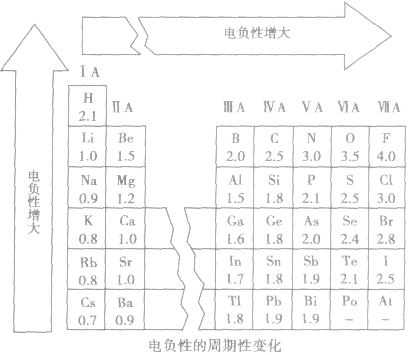
(4)电负性的变化规律
①随原子序数的递增,元素的电负性呈周期性变化。
②同周期,从左到右,元素的电负性逐渐变大。
③同主族,从上到下,元素的电负性逐渐变小。
电负性的应用:
①判断元素的金属性和非金属性的强弱
金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②判断元素化合价的正负
利用电负性可以判断化合物中元素化合价的正负:电负性大的元素易呈现负价,电负性小的元素易呈现正价。
③判断化学键的类型
一般认为,如果成键原子所属元素的电负性差值大于 1.7,它们之间通常形成离子键;如果成键原子所属元素的电负性差值小于1.7,它们之间通常形成共价键。
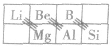
④解释“对角线规则”
在元素周期表中,某些主族元素与其右下方的主族元素(如右图所示)的有些性质是相似的,被称为“对角线规则”。例如:硼和硅的含氧酸盐都能形成玻璃且互熔,含氧酸都是弱酸等。
氢键:
(1)概念:已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力。如水分子问的氢键如下图所示。 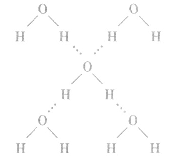
(2)表示方法:A—H…B一(A、B为N、O、F“一” 表示共价键,“…”表示形成的氢键)。
(3)分类
(4)属性:氢键不属于化学键,它属于一一种较强的分子间作用力,其作用能大小介于范德华力和化学键之间。
(5)对物质性质的影响
①氢键对物质熔、沸点的影响。分子问存在氧键时,破坏分子问的氢键,需要消耗更多的能量,所以存在氢键的物质具有较高的熔点和沸点。
例如:氮族、氧族、卤素中的N、O、F的氧化物的熔、沸点的反常现象。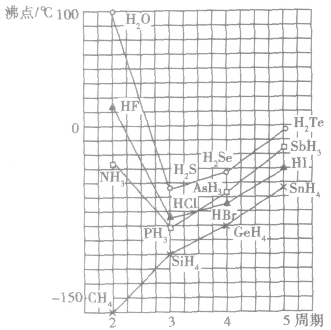
②氢键对物质溶解度的影响:氢键的存在使物质的溶解性增大。例如:NH3极易溶解于水,主要是由于氨分子和水分子之问形成了氢键,彼此互相缔合,因而加大了溶解。再如乙醇、低级醛易溶于水,也是因为它们能与水分子形成氢键。
③氢键的存在会引起密度的变化。水结冰时体积膨胀、密度减小的反常现象也可用氢键解释:在水蒸气中水以单个的水分子形式存在;在液态水中,通常是几个水分子通过氢键结合,形成(H2O)n小集团;在固态水(冰)中,水分子大范围地以氢键互相连接,成为疏松的晶体,因此在冰的结构中有许多空隙,造成体积膨胀,密度减小。
④分子内氢键与分子间氢键对物质性质的不同影响:氢键既可以存在于分子内部的原子之间,也可以存在于分子间的原子之间,只不过这两种情况对物质性质的影响程度是不一样的。例如,邻羟基苯甲醛存在分子内氢键: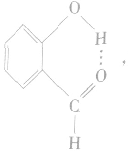 熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键:
熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键: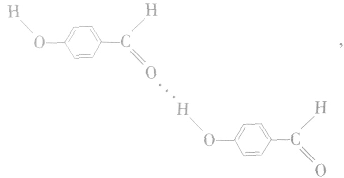 熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
6)存在:水、醇、羧酸、酰胺、氨基酸、蛋白质、结晶水合物等物质中都能存在;生命体中许多大分子内也存在氢键,如氢键是蛋白质具有生物活性的高级结构的重要原因,DNA双螺旋的两个螺旋链也是以氢键相互结合的。
与“选修《物质结构》三氟化氮是一种无色、无味、无毒且不可燃的...”考查相似的试题有:
- (1)请写出Cr原子基态的电子排布式:______.(2)H3O+的空间构型是______,其中O原子呈______杂化.(3)Fe(CO)5常温下呈...
- 试用杂化轨道理论说明下列分子或离子的几何构型。(1)CO2______ (2)SiF4______(3)BCl3______ (4)NF3______(5)NO2-______
- A、B、C、D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物;C和D属同...
- 下列有关说法不正确的是( )A.零族元素的单质在常温下都是气体B.第ⅡA族元素都是金属元素C.Fe位于周期表的第四周期,第ⅧB...
- 碘单质及其化合物具有重要应用。下列说法正确的是[ ]A.从海带中提取的过程只发生物理变化B.互为同位素C.加碘食盐能使淀粉...
- X、Y、Z三种短周期元素,原子序数依次增大,其最外层电子数之和为15,它们分别是所在周期最活泼的金属或非金属元素。其中Y元...
- 第三周期元素中,最易与氢气反应生成气态氢化物的是( )A.钠B.硅C.硫D.氯
- 按C、N、O、F的顺序,下列递变规律正确的是( )A.原子半径逐渐增大B.元素原子得电子能力逐渐减弱C.气态氢化物稳定性逐渐...
- 下图是元素周期表中的一部分.在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增...
- 美国科学家宣称发现了普通盐水在无线电波照射下可燃烧,有望解决用水作人类能源的重大问题。无线电频率可以降低盐水中所含元...