本试题 “向下图装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液退色,加热后又恢复红色.据此判断气体X和洗气瓶...” 主要考查您对二氧化硫
气体的检验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化硫
- 气体的检验
二氧化硫:
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的制备:
工业制法:

实验室制法:
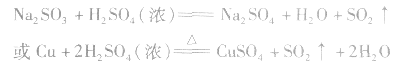
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


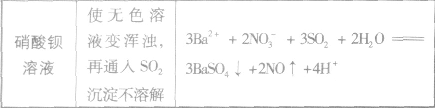
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表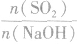 ,如下数轴所示:
,如下数轴所示: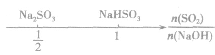
分析数轴可得:
(1)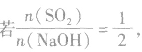 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)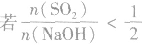 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)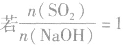 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)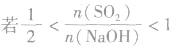 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)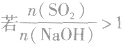 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
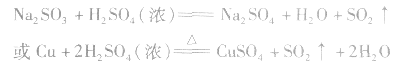
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

气体检验的方法:
(1)观察法:对于特殊颜色的气体如Cl2(黄绿色)、NO2(红棕色)、碘蒸气(紫红)可据此辨之。
(2)溶解法:根据溶于水的现象不同区分,如NO2和溴蒸气均为红棕色,但溶于水后NO2形成无色溶液;溴形成橙色溶液。
(3)褪色法:SO2和CO2可用品红溶液区分。
(4)氧化法:被空气氧化看变化,如NO的检验。
(5)试纸法:如石蕊试纸、醋酸铅试纸。
(6)星火发:适用于有助燃性或可燃性的气体检验,如O2使带火星木条复燃;CH4和C2H2的检验可点燃看现象;CH4、CO、H2则可根据其燃烧产物来判断。
常见气体的检验:
(1)H2:无色、无味、可燃;①不纯点燃发出爆鸣声;②点燃纯H2,火焰呈淡色,火焰上方罩一干燥烧杯,烧杯壁上有水珠生成:2H2+O2 2H2O
2H2O
(2)O2:无色无味、能使余烬木条复燃;
(3)Cl2:黄绿色刺激性气体有毒;①使湿润淀粉碘化钾试纸变蓝:Cl2+2KI=2KCl+I2 I2遇淀粉变蓝;②使湿润蓝色石蕊试纸先变红后变白:Cl2+H2O=HCl+HClO HClO强氧化性漂白作用;
(4)CO2:无色无味无毒;①使燃着木条熄灭;②通入澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O
(5)CO:无色、无味、剧毒;点燃火焰呈蓝色,火焰上方罩一沾有石灰水液滴的烧杯,液滴变浑浊:
2CO+O2 2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
(6)NO2: 红棕色气体有刺激性气味、有毒,溶于水、水溶液呈酸性,能使紫色石蕊试液变红:3NO2+H2O=2HNO3+NO
(7)NO:无色气体有毒;在空气中立即变为红棕色:2NO+O2=2NO2
(8)N2: 无色无味无毒;能使燃着木条熄灭。
(9)SO2:无色有刺激性气味、有毒;①通入品红溶液,品红褪色加热又恢复颜色;②使澄清石灰水变浑浊:
SO2+Ca(OH)2=CaSO3+H2O;
③使酸性高锰酸钾溶液褪色:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
(10)HCl:无色刺激性气味;①能使湿润蓝色石蕊试纸变红:HCl=H++Cl-; ②用蘸浓氨水玻璃棒靠近冒白烟:NH3+HCl=NH4Cl;③气体通入HNO3酸化的AgNO3溶液,有白色沉淀生成:HCl+AgNO3=AgCl↓+HNO3 (AgCl不溶于HNO3)
(11)H2S:无色臭鸡蛋气味有毒;遇Pb(NO3)2 、(CH3COO)2Pb、CuSO4溶液均产生黑色沉淀:Pb2++H2S=PbS↓+2H+;2CH3COO-+Pb2++H2S=PbS↓+2CH3COOH;Cu2++H2S=CuS↓+2H+
(12)NH3:无色刺激性气味;①遇湿润红色石蕊试纸变蓝:NH3+H2O NH3?H2O
NH3?H2O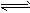 NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
(13)CH4:无色无味、可燃;点燃后火焰呈浅蓝色,火焰上方罩一干燥烧杯,烧杯壁上有水珠罩生成;罩一沾有石灰水液滴的烧杯,液滴变浑浊:CH4+2O2 CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
(14)C2H4: 无色稍有气味;①点燃,火焰明亮(少量黑烟):C2H4+3O2 2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br
2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br
(15)C2H2:无色无味;①点燃火焰明亮并伴有大量黑烟:2C2H2+5O2 4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
(1)观察法:对于特殊颜色的气体如Cl2(黄绿色)、NO2(红棕色)、碘蒸气(紫红)可据此辨之。
(2)溶解法:根据溶于水的现象不同区分,如NO2和溴蒸气均为红棕色,但溶于水后NO2形成无色溶液;溴形成橙色溶液。
(3)褪色法:SO2和CO2可用品红溶液区分。
(4)氧化法:被空气氧化看变化,如NO的检验。
(5)试纸法:如石蕊试纸、醋酸铅试纸。
(6)星火发:适用于有助燃性或可燃性的气体检验,如O2使带火星木条复燃;CH4和C2H2的检验可点燃看现象;CH4、CO、H2则可根据其燃烧产物来判断。
常见气体的检验:
(1)H2:无色、无味、可燃;①不纯点燃发出爆鸣声;②点燃纯H2,火焰呈淡色,火焰上方罩一干燥烧杯,烧杯壁上有水珠生成:2H2+O2
 2H2O
2H2O (2)O2:无色无味、能使余烬木条复燃;
(3)Cl2:黄绿色刺激性气体有毒;①使湿润淀粉碘化钾试纸变蓝:Cl2+2KI=2KCl+I2 I2遇淀粉变蓝;②使湿润蓝色石蕊试纸先变红后变白:Cl2+H2O=HCl+HClO HClO强氧化性漂白作用;
(4)CO2:无色无味无毒;①使燃着木条熄灭;②通入澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O
(5)CO:无色、无味、剧毒;点燃火焰呈蓝色,火焰上方罩一沾有石灰水液滴的烧杯,液滴变浑浊:
2CO+O2
 2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
2CO2 CO2+Ca(OH)2=CaCO3↓+H2O (6)NO2: 红棕色气体有刺激性气味、有毒,溶于水、水溶液呈酸性,能使紫色石蕊试液变红:3NO2+H2O=2HNO3+NO
(7)NO:无色气体有毒;在空气中立即变为红棕色:2NO+O2=2NO2
(8)N2: 无色无味无毒;能使燃着木条熄灭。
(9)SO2:无色有刺激性气味、有毒;①通入品红溶液,品红褪色加热又恢复颜色;②使澄清石灰水变浑浊:
SO2+Ca(OH)2=CaSO3+H2O;
③使酸性高锰酸钾溶液褪色:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
(10)HCl:无色刺激性气味;①能使湿润蓝色石蕊试纸变红:HCl=H++Cl-; ②用蘸浓氨水玻璃棒靠近冒白烟:NH3+HCl=NH4Cl;③气体通入HNO3酸化的AgNO3溶液,有白色沉淀生成:HCl+AgNO3=AgCl↓+HNO3 (AgCl不溶于HNO3)
(11)H2S:无色臭鸡蛋气味有毒;遇Pb(NO3)2 、(CH3COO)2Pb、CuSO4溶液均产生黑色沉淀:Pb2++H2S=PbS↓+2H+;2CH3COO-+Pb2++H2S=PbS↓+2CH3COOH;Cu2++H2S=CuS↓+2H+
(12)NH3:无色刺激性气味;①遇湿润红色石蕊试纸变蓝:NH3+H2O
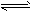 NH3?H2O
NH3?H2O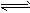 NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl (13)CH4:无色无味、可燃;点燃后火焰呈浅蓝色,火焰上方罩一干燥烧杯,烧杯壁上有水珠罩生成;罩一沾有石灰水液滴的烧杯,液滴变浑浊:CH4+2O2
 CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O (14)C2H4: 无色稍有气味;①点燃,火焰明亮(少量黑烟):C2H4+3O2
 2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br
2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br (15)C2H2:无色无味;①点燃火焰明亮并伴有大量黑烟:2C2H2+5O2
 4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2 物质检验的基本原则:
物质检验的“三个原则”,即一看(颜色、状态)、二嗅(气味)、三实验(加试剂)。根据实验时生成物所表现的现象不同,检验离子的方法可归纳为四类:
(1)生成气体,如 的检验;
的检验;
(2)生成沉淀,如 的检验;
的检验;
(3)显现特殊颜色,如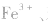 苯酚的检验。
苯酚的检验。
(4)焰色反应:检验金属或金属离子。
发现相似题
与“向下图装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化...”考查相似的试题有:
- 某雨水样品刚采集时测得pH为4.82,放在烧杯中2小时后,再次测得pH为4.68,以下叙述正确的是…()A.雨水样品酸度逐渐减小B....
- 已知:A、E是非金属固体单质,气体F能使品红溶液褪色,C分子中有22个电子。A—H有如下转化关系(有部分产物略去): 请回答:...
- 面粉增白剂主要包括过氧化苯甲酰(俗称面粉增白剂)和过氧化钙两种物质。其中过氧化钙(CaO2) 在日常生活和工农业生产中还常用...
- 现有下列4种物质:①NH3、②SO2、③NaCl溶液、④H2SO4溶液.其中,能使品红溶液褪色的是______(填序号,下同),焰色反应呈黄色...
- 全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:(1)空...
- 有两支盛硝酸钡溶液的试管,向一支里加入盐酸,向另一支里加入烧碱溶液,再同时通入SO2,都有白色沉淀生成,由此可得出的结论...
- 下列能达到实验目的是( ) A.进行喷泉实验 B.干燥HBr气体 C.稀释浓硫酸 D.制备少量O2
- 一定量的浓硫酸与足量Zn充分反应时,有SO2和H2生成。某校化学研究性学习小组分别从定性和定量两方面对此作了研究。定性实验:...
- 【化学与技术】以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如下:(1)写出流程图中一种氧化物的名称 。 ...
- 有几个实验小组的同学,利用如图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢慢滴下;b中盛放的药品足量;若在c、d中...