本试题 “判断下列有关化学基本概念的依据正确的是[ ]A.氧化还原反应:元素化合价是否变化B.共价化合物:是否含有共价键C.强弱电解质:溶液的导电能力大小D.金属晶...” 主要考查您对氧化还原反应的定义
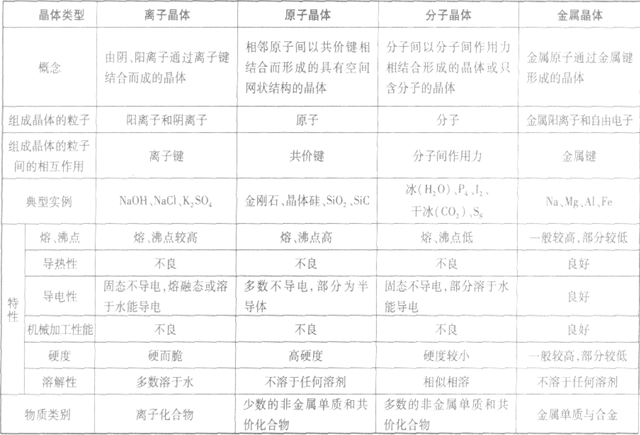
金属晶体
共价化合物
强电解质、弱电解质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的定义
- 金属晶体
- 共价化合物
- 强电解质、弱电解质
氧化还原反应:
有电子转移(得失或偏移)的反应;(无电子转移(得失或偏移)的反应为非氧化还原反应)
反应历程:
氧化还原反应前后,元素的氧化数发生变化。根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应;氧化数降低的反应,称为还原反应。氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。
氧化还原反应中存在以下一般规律:
强弱律:氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态。
优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
氧化还原性的强弱判定:
物质的氧化性是指物质得电子的能力,还原性是指物质失电子的能力。物质氧化性、还原性的强弱取决于物质得失电子的能力(与得失电子的数量无关)。从方程式与元素性质的角度,氧化性与还原性的有无与强弱可用以下几点判定:
(1)从元素所处的价态考虑,可初步分析物质所具备的性质(无法分析其强弱)。最高价态——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低价态,只有还原性,如Cl-、S2-等;中间价态——既有氧化性又有还原性,如Fe、S、SO2等。
(2)根据氧化还原的方向判断:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(3)根据反应条件判断:当不同的氧化剂与同一种还原剂反应时,如氧化产物中元素的价态相同,可根据反应条件的高、低进行判断,如是否需要加热,是否需要酸性条件,浓度大小等等。
电子的得失过程:

其过程用核外电子排布变化情况可表示为:
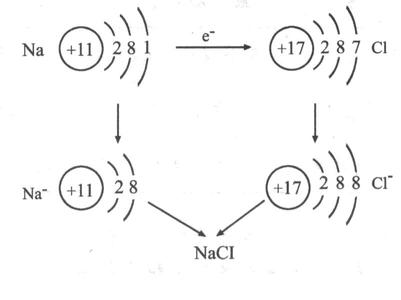
通过金属离子与自由电子间的较强作用(金属键)形成的单质晶体,熔沸点(除Hg外)高,导热性、延展性良好,易导电,硬度一般较大。
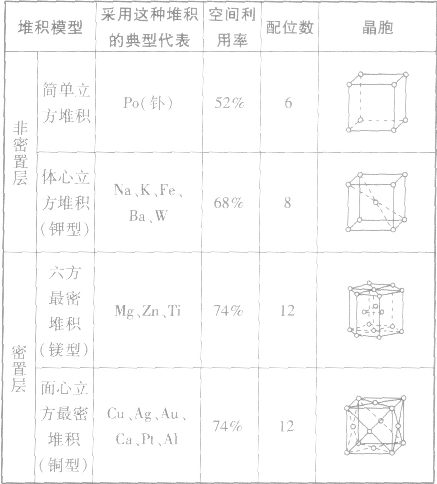
如:金属单质金属晶体原子堆积模型:
(1)简单立方堆积 (2)体心立方堆积 (3)六方最密堆积和面心立方最密堆积
晶体的基本类型与性质:
金属晶体的原子堆积模型:
直接相邻原子间均以共价键相结合的化合物。共价化合物中只含共价键。
离子化合物和共价化合物的比较:

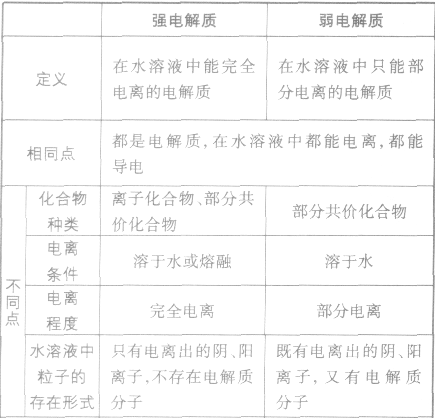
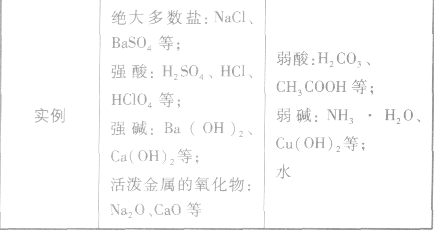
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“
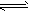 ”表示。
”表示。 强电解质和弱电解质的比较:
强弱电解质的判断依据:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验.
2.浓度与pH的关系。如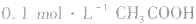 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。
3.测定对应盐溶液的酸碱性。如 溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。
4.稀释前后的pH变化与稀释倍数的关系。例如,将pH=2的酸溶液稀释1000倍,若pH<5,则证明该酸为弱电解质;若pH=5,则证明该酸为强电解质。
5.采用实验证明电离平衡。如向醋酸溶液中滴人石蕊试液,溶液变红,再加入醋酸钠晶体,颜色变浅。
与“判断下列有关化学基本概念的依据正确的是[ ]A.氧化还原反应...”考查相似的试题有:
- 下面是厨房中的常见操作或现象,其中不属于氧化还原反应的是( )A.铁锅经放置出现红棕色斑迹B.以沼气为燃料为炒菜提供热量...
- 今有三个氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O若某溶液中有Fe2...
- 下列变化中,需加入还原剂的是( )A.SO32-→SO2B.S2-→SC.CO2→H2CO3D.CO2→CO
- 需要加入还原剂才能实现的转化是( )A.Na→NaOHB.HCl→Cl2C.Fe→Fe3+D.HNO3→NO
- 下列叙述中正确的是( )A.含最高价元素的化合物,一定具有强氧化性B.阳离子只有氧化性,阴离子只有还原性C.失电子越多,...
- 下列反应中不属于氧化还原反应的是( )A.2H2O2催化剂.2H2O+O2↑B.2Na+2H2O=2NaOH+H2↑C.CaO+SiO2高温.CaSiO3D.2KI+Cl2=2KC...
- 有关晶格能的叙述正确的是A.晶格能是气态离子形成1摩离子晶体释放的能量B.晶格能通常取正值,但是有时也取负值C.晶格能越...
- 下列特性适合金属晶体的是( )A.熔点1031 ℃,固态不导电,水溶液能导电B.熔点97.81 ℃,固态能导电,质软C.熔点162.7 ℃,...
- 下列电离方程式,书写正确的是A.KMnO4=K++Mn7++4O2-B.NaHCO3=Na++H++CO32-C.AlCl3=Al3++Cl3-D.Al2(SO4)3=2Al3++3SO42-
- 下列关于电解质的说法正确的是( )A.强电解质溶液的导电性一定比弱电解质溶液的导电性强B.强电解质都是离子化合物,而弱电...