本试题 “下列说法中,正确的是[ ]A、元素间的根本区别在于原子中的最外层电子数不同B、黄铜是铜锌合金,其熔点比铜低,硬度比铜大C、t℃10gKCl加入50g水中能全部溶解,...” 主要考查您对固体溶解度
化合价的求法
元素的定义
合金
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 固体溶解度
- 化合价的求法
- 元素的定义
- 合金
概念:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)
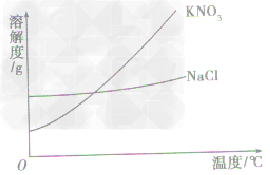
(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)

(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
求化合价:
化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。在化合物中正、负化合价代数和等于零,这是求化合价的准则。
几种求法:
一、由化学式或根式
1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数
2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数
3.根据正、负电荷数判断元素(或原子团)的化合价。 在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素质量比
1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值
2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量
三、由质量比
(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值
正负代化合价数和为零:
【例1】试确定化合物K2MnO4中Mn元素的化合价。 解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
电子层结构法
【例2】元素X的原子最外层上有1个电子,元素Y的原子最外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[] A.XYB.X2YC.XY2D.X3Y 解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
质量分数法
【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[] A.+1B.+2C.+3D.+4 解析:设该元素的氧化物化学式为RxOy 依题意有59x/(59x+16y)*100%=71% 解得x/y=2:3 故化学式为R2O3,R化合价为+3价,选C。
质量守恒定律法
【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是[] A.+1B.+2C.+3D.+4
解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
相对分子质量法
【例5】某金属元素的氧化物相对分子质量为M,同价态的氯化物相对分子质量为N,则该元素的化合价数值为[]
解析:设该元素化合价为+x价,相对原子质量为MR
(1)如x为奇数时,氧化物化学式为R2Ox,氯化物化学式为RClx,据题意有
2MR+16x=M(1)
MR+35.5x=N(2)
(2)*2-(1)得x的值为x=+(2N-M)/55
(2)x为偶数时,氧化物化学式为Rox/2氯化物化学式为RClx,据题意有 MR+35.5x=N(4) x=+(N-M)/27.5
质量关系法
【例6】相对原子质量为M的金属单质ag与足量的稀硫酸反应,产生bg氢气,则反应中该金属元素的化合价为[]
解析:设金属在反应中化合价为+x价,则金属单质与生成H2有如下关系:
2R~xH2
2M 2x
a b
故应选B。
相关因素讨论法
【例7】某元素M原子最外层电子数少于5,其氧化物化学式为MxOy,氯化物化学式MClz当y∶z=1∶2时,M的化合价可能是[]
A.+1B.+2C.+3D.+4
解析:M的化合价在数值上等于z的值
如y=1z=2(合理) y=2z=4(合理) y=3z=6(与最外层电子数少于5不符) 故应选B、D。
化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。在化合物中正、负化合价代数和等于零,这是求化合价的准则。
几种求法:
一、由化学式或根式
1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数
2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数
3.根据正、负电荷数判断元素(或原子团)的化合价。 在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素质量比
1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值
2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量
三、由质量比
(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值
正负代化合价数和为零:
【例1】试确定化合物K2MnO4中Mn元素的化合价。 解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
电子层结构法
【例2】元素X的原子最外层上有1个电子,元素Y的原子最外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[] A.XYB.X2YC.XY2D.X3Y 解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
质量分数法
【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[] A.+1B.+2C.+3D.+4 解析:设该元素的氧化物化学式为RxOy 依题意有59x/(59x+16y)*100%=71% 解得x/y=2:3 故化学式为R2O3,R化合价为+3价,选C。
质量守恒定律法
【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是[] A.+1B.+2C.+3D.+4
解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
相对分子质量法
【例5】某金属元素的氧化物相对分子质量为M,同价态的氯化物相对分子质量为N,则该元素的化合价数值为[]
解析:设该元素化合价为+x价,相对原子质量为MR
(1)如x为奇数时,氧化物化学式为R2Ox,氯化物化学式为RClx,据题意有
2MR+16x=M(1)
MR+35.5x=N(2)
(2)*2-(1)得x的值为x=+(2N-M)/55
(2)x为偶数时,氧化物化学式为Rox/2氯化物化学式为RClx,据题意有 MR+35.5x=N(4) x=+(N-M)/27.5
质量关系法
【例6】相对原子质量为M的金属单质ag与足量的稀硫酸反应,产生bg氢气,则反应中该金属元素的化合价为[]
解析:设金属在反应中化合价为+x价,则金属单质与生成H2有如下关系:
2R~xH2
2M 2x
a b
故应选B。
相关因素讨论法
【例7】某元素M原子最外层电子数少于5,其氧化物化学式为MxOy,氯化物化学式MClz当y∶z=1∶2时,M的化合价可能是[]
A.+1B.+2C.+3D.+4
解析:M的化合价在数值上等于z的值
如y=1z=2(合理) y=2z=4(合理) y=3z=6(与最外层电子数少于5不符) 故应选B、D。
概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
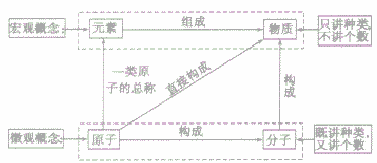
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;
在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
| 元素 | 原子 | |
| 概念 | 具有相同核电荷数〔即核内质子数)的一类原子的总称 | 化学变化中的最小粒子 |
| 区分 | 只讲种类,不讲个数 | 既讲种类,又讲个数 |
| 使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
| 举例 | 水由氢元素和氧元素组成,或说水中含有氢元素和氧元素 | 每个水分子由两个氢原子和一个氧原子构成 |
| 联系 | 元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称一种元素可以包含几种原子 | |
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;

在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
合金的概念:
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类
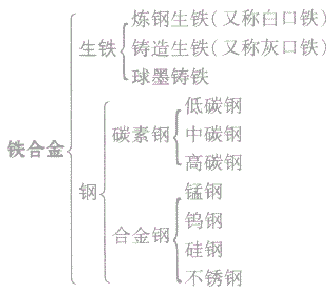
(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
| 含碳量 | 2%—4% | 0.03%—2% |
| 其他元素 | Si、Mn、S、P(少量) | Si、Mn等 |
| 机械性能 | 硬而脆,无韧性 | 坚硬,韧性大,塑性好,有弹性 |
| 机械加工性质 | 可铸不可锻 | 可铸,可锻,可压延 |
| 分类 | 白口铁,灰口铁,球墨铸铁 | 碳素钢,合金钢 |
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类

(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
发现相似题
与“下列说法中,正确的是[ ]A、元素间的根本区别在于原子中的最...”考查相似的试题有:
- 如图所示是A、B、C三种物质的溶解度曲线,据此图回答:(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;(2)t2℃时,...
- 在80℃时,物质A的溶解度比B小.分别取等质量的A、B两物质的饱和溶液,降温至30℃,析出A、B晶体的质量分别为mg和ng(A、B均不...
- “84消毒液”的主要成分是次氯酸钠(化学式为NaClO),次氯酸钠中氯元素的化合价为A.+5价B.+1价C.+3价D.-1价
- 亚硫酸钠(Na2SO3)是一种重要的化工原料,大量用于染料工业.亚硫酸钠中硫元素的化合价是( )A.-2B.+2C.+4D.+6
- 乳酸(化学式为C3H6O3)是近年来人们研究的热点之一,因为它在医药、食品等领域有广阔的应用前景.下列关于乳酸的说法正确的...
- 一氧化碳(1)物理性质:无色,无味的气体,密度比空气 , 溶于水.(2)有毒.原因是: .(3)化学性质:(H2、CO、CH4具有...
- 下列关于物质组成的判断正确的是[ ]A.二氧化碳中含有碳元素B.葡萄糖、蔗糖、面粉中都含有碳元素C.氧化镁中也含有碳元素D....
- 几种常见合金(1)铁合金:主要包括______和______,它们的区别是______,生铁含碳量______,钢的含碳量为______.钢比生铁具...
- “归纳法”是常用的学习方法之一.下列是小亮对有关铁知识的归纳,错误的一项是( )A.钢是纯净物B.铁在潮湿的空气中易生锈C...
- 焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是( )A.增加强度B.降低熔点C.增加延展性D.增强抗腐蚀性